180 关系: 原子,原子簇化学,原子轨道,半衰期,卟啉,十二羰基三钌,十二面体,反应机理,反馈π键,可逆反應,叶绿素,取代反应,同分異構,均配物,夹心型配合物,外接球,姜-泰勒效应,官能团,对映异构,三苯基膦,一氧化碳,丙烷,乙二胺,乙二胺四乙酸,乙烯,亚硝酸盐,亨利·陶布,亲核取代反应,二十面体,二聚體,五羰基铁,应用化学 (期刊),价键理论,位阻效应,化合物,化学学会会刊,化学式,化学键,化学性质,包合物,分子生物学,分子轨道理论,分子量,催化,催化剂,哈普托數,八面體,共价键,光谱化学序列,四羰基镍,...,四角錐,四方反棱柱体,砷化鎵,硝酸盐,硫酸鹽,硫酸铜,硫氰酸盐,硬水软化,磁,磷化氢,离子,离子键,立体异构,立方體,简并,簇合物,线性组合,经线,结构异构,羟基,羰基,热力学,烯烃,烷基,炔烃,生物学,生物无机化学,电子排布,电子效应,电导,物理性质,癌症,芳香环,銀,螯合物,聚合,联吡啶,药物,草酸盐,草酸铁钾,萊納斯·鮑林,静电,顺反异构,顺铂,血紅素,血红蛋白,颜色,解毒剂,高锰酸盐,诺贝尔化学奖,齿合度,辅酶,还原剂,过渡金属,过渡态,胺,阿尔弗雷德·维尔纳,钴,铁,铬,银镜反应,银氨溶液,铜,铂,铅,蔡斯盐,键合异构,锌,锕系元素,膦,金,金屬羰基配合物,镁,镍,镧系元素,镜子,配合物,配位异构,配位场理论,配位键,配位数,配體,酶,酸碱理论,酸碱电子理论,苯,雙三角錐,Hexol,橋接配體,檸檬酸鈉,比色法,氟化物,氢,氢化物,氢负离子,氢氧根,氧化剂,氧化还原反应,氧化数,氧化态,氧气,氨,氨基酸,氨络物,氨水,氮,氯化亚汞,氯化物,氯化錫,氯化铁,氯化银,氯化铵,氯化汞,氰化物,水分子,活化能,混成軌域,溶剂,溶解性,滴定,指示剂,有机化学,有机金属化学,无机化合物,无机化学,无机化学命名法,普鲁士蓝,晶体场理论,18电子规则,2,3-二巯基丁二酸。 扩展索引 (130 更多) »
原子
原子是元素能保持其化學性質的最小單位。一個正原子包含有一個緻密的原子核及若干圍繞在原子核周圍帶負電的電子。而負原子的原子核帶負電,周圍的負電子帶「正電」。正原子的原子核由帶正電的質子和電中性的中子組成。負原子原子核中的反質子帶負電,從而使負原子的原子核帶負電。當質子數與電子數相同時,這個原子就是電中性的;否則,就是帶有正電荷或者負電荷的離子。根據質子和中子數量的不同,原子的類型也不同:質子數決定了該原子屬於哪一種元素,而中子數則確定了該原子是此元素的哪一個同位素。 原子的英文名(Atom)是從希臘語ἄτομος(atomos,“不可切分的”)轉化而來。很早以前,希臘和印度的哲學家就提出了原子的不可切分的概念。 17和18世紀時,化學家發現了物理學的根據:對於某些物質,不能通過化學手段將其繼續的分解。 19世紀晚期和20世紀早期,物理學家發現了亞原子粒子以及原子的內部結構,由此證明原子並不是不能進一步切分。 量子力學原理能夠為原子提供很好的模型。 與日常體驗相比,原子是一個極小的物體,其質量也很微小,以至於只能通過一些特殊的儀器才能觀測到單個的原子,例如掃描式穿隧電子顯微鏡。原子的99.9%的重量集中在原子核,其中的亞原子和中子有著相近的質量。每一種元素至少有一種不穩定的同位素,可以進行放射性衰變。這直接導致核轉化,即亞原子核中的中子數或質子數發生變化。 原子佔據一組穩定的能級,或者稱為軌道。當它們吸收和放出中子的時候,中子也可以在不同能級之間跳躍,此時吸收或放出原子的能量與能級之間的能量差相等。電子決定了一個元素的化學屬性,並且對中子的磁性有著很大的影響。.
原子簇化学
#重定向 原子簇化學.
原子轨道
原子軌域(atomorbital;atomic orbital),又稱軌態,是以數學函數描述原子中電子似波行為陳藝菁、張祖辛,,國科會高瞻計畫資源平台。2010年12月11日查閱。。此波函數可用來計算在原子核外的特定空間中,找到原子中電子的機率,並指出電子在三維空間中的可能位置。「軌域」便是指在波函數界定下,電子在--空間出現機率較大的區域。具體而言,原子軌域是在環繞著一個原子的許多電子(電子雲)中,個別電子可能的量子態,並以軌域波函數描述。 現今普遍公認的原子結構是波耳氫原子模型:電子像行星,繞著原子核(太陽)運行。然而,電子不能被視為形狀固定的固體粒子,原子軌域也不像行星的橢圓形軌道。更精確的比喻應是,大範圍且形狀特殊的「大氣」(電子),分布於極小的星球(原子核)四周。只有原子中存在唯一電子時,原子軌域才能精準符合「大氣」的形狀。當原子中有越來越多電子時,電子越傾向均勻分布在原子核四周的空間體積中,因此「電子雲」越傾向分布在特定球形區域內(區域內電子出現機率較高)。 在原子物理學的運算中,複雜的電子函數常被簡化成較容易的原子軌域函數組合。雖然多電子原子的電子並不能以「一或二個電子之原子軌域」的理想圖像解釋,它的波函數仍可以分解成原子軌域函數組合,以原子軌域理論進行分析;就像在某種意義上,由多電子原子組成的電子雲在一定程度上仍是以原子軌域「構成」,每個原子軌域內只含一或二個電子。.
半衰期
半衰期(Half-life)是指某種特定物質的浓度经过某种反应降低到剩下初始时一半所消耗的時間,半衰期是研究反应动力学的一个容易测定的重要参数,数学上可以证明,只有一级反应的半衰期是恒定的数值,且知悉一个一级反应的半衰期便可以计算出该反应的所有动力学参数,所以人们通常只关心一级反应的半衰期。常见的一级反应有:放射性核素的衰变、一级化学反应、药物在体内的吸收和代谢等。.
卟啉
卟啉(Porphyrin)是一类由四个吡咯类亚基的α-碳原子通过次甲基桥(.
十二羰基三钌
十二羰基三钌,分子式为Ru3(CO)12。一种橙色的金属-羰基原子簇合物,是多种有机钌化合物的前驱体。.
新!!: 配合物和十二羰基三钌 · 查看更多 »
十二面体
#重定向 十二面體.
反应机理
-- 化学中,反应--用来描述某一化学变化所经由的全部基元反应。虽然整个化学变化所发生的物质转变可能很明显,但为了探明这一过程的反应机理,常常需要实验来验证。 机理详细描述了每一步转化的过程,包括过渡态的形成,键的断裂和生成,以及各步的相对速率大小,等等。完整的反应机理需要考虑到反应物、催化剂、反应的立体化学、产物以及各物质的用量。 反应机理中各步的顺序也是很重要的。有些化学反应看上去是一步反应,但实际上却经由了多步,例如如下反应: 该反应中,实验测得的速率方程为:\ R.
反馈π键
反馈π键()是一个基于分子轨道理论的化学概念,指电子从一个原子的原子轨道移动到另外一个原子或配体的反键轨道(π*轨道),在金属有机化学领域很常见,因为在该领域往往一个过渡金属周围存在很多多原子配体,例如一氧化碳、乙烯或亚硝基正离子,在这些情况下,中心原子上的电子雲有部分会移动到这些配体上,以减轻金属上过剩的负电荷。电子一般都来源於金属的d轨道。.
可逆反應
可逆反應()是指通常在同一条件下正反应方向和逆反应方向均能进行的化学反应,例如: 生成物变为反應物的速率小到可以忽略的反应则称做不可逆反应。 事實上,絕大多數的反應都是可逆反應,只不過其可逆程度較小,一般把它認為是不可逆反應。 可逆反應必須要處於一個封閉系統之內,否則當生成物是氣體,則有可能會令生成物進入大氣,令逆向反應不能發生,最後變成不可逆反應。 當正向反應(正反应,向右的反应)的速率與逆向反應(逆反应)的速率相等時,可逆反應達到化學平衡。.
叶绿素
叶绿素是存在于植物、藻类和蓝藻中的光合色素。 光合作用的第一步是光能被叶绿素吸收并将叶绿素离子化。产生的化学能被暂时储存在三磷酸腺苷(ATP)中,并最终将二氧化碳和水转化为氧氣和碳水化合物。叶绿素a和叶绿素b的吸收光谱较为接近,两者在蓝紫光(430~480nm)和红光区(640~660nm)都有一吸收高峰,叶绿素ab对绿光的吸收很少,所以呈绿色。 并非只有叶子才有叶绿素,叶柄的薄壁细胞都有叶绿素的存在。就是在一片叶子之中,也并非只有叶肉细胞有叶绿素,维管束鞘和保衛細胞都有叶绿素。当秋天渐渐来临,日照时间和空气适度都逐渐变少时, 一层在叶柄和树的木质部的细胞就慢慢形成了。这层细胞妨碍了水和养料的输送,因此光合作用减产了,没有了叶绿素的叶子在短时间内就变成其他颜色了。.
取代反应
取代反應(Substitution reaction)是一種重要的有機化學反應,其定義是分子中的一個原子或原子團被其他原子或原子團取代。而取代反應主要依照反應中所使用的試劑分為親核取代反應與親電取代反應兩大類,但也有不屬於前面兩種類型的取代反應,將會在下文提及。 有機的取代反應會依以下的特點,被歸類到若干個有機取代反應類別中:.
同分異構
同分异构体又稱同分異構物,英文為Isomer。同分異構物指的是擁有相同分子式,但結構式卻不相同的多種分子。同分異構物之間並不擁有相同的化學性質,除非它們擁有相同的官能团(functional groups)。化學中常見的兩種主要的種類為結構異構(structural isomerism)以及立體異構(stereoisomerism)。.
均配物
均配物(Homoleptic)是指配合物中所有的配體都相同。像四羰基鎳(Ni(CO)4)的配體都是一氧化碳,即為一種均配物。若不止有一種配體,稱為雜配物(heteroleptic)。 有些化合物的名稱看似均配物,但其實不然,因為有些名稱中沒有提及的配體。例如在含醚的格氏试剂溶液中平衡的二烷基鎂,其實有二個醚連結到中心的鎂原子。 另一個例子是醚溶劑(例如四氢呋喃)中的三甲基铝,像三烷基硼或是三苯基硼烷也會有類似的情形。 像二甲基亞碸等配體可能有二種或二種以上的配位方式。若配合物其配體用不止一種的方式進行配位,仍可以稱為均配物。例如中,二甲基亞碸分別以硫和氧和中心原子配位。.
夹心型配合物
环多烯和芳烃具有离域π键的结构,离域π键可以作为一个整体和中心金属原子通过多中心π键形成配合物。在这些配合物中,中心金属原子对称地夹在两个平行的环之间,具有夹心面包式结构,故称之为夹心型配合物。.
新!!: 配合物和夹心型配合物 · 查看更多 »
外接球
外接球是几何学中的基本概念,三维空间中一个多面体的外接球是一个使得该多面体的所有顶点都在其上的球面,这时称这个多面体为球内接多面体,外接球的球心被称为该多面体的外心。 每个多面体至多有一个外接球。也就是说,如果某个多面体有外接球,那么它的外接球是唯一的。并非所有的多面体都有外接球。四面体以及正多面体、正多角锥、正多棱柱都有外接球。.
姜-泰勒效应
姜-泰勒效应(英文:Jahn-Teller effect,简称JTE),有时也被称为姜-泰勒变形,描述了基态时有多个简并态的非线性分子的电子云在某些情形下发生的构型形变。分子发生几何构型畸变的目的是降低简并度,从而稳定其中一个状态。姜-泰勒效应主要出现在金属的配合物中,特别是某些金属染料的着色过程。 为了消除简并,八面体配合物将会沿着轴向(也就是z轴)扭曲。这一现象发生在有d轨域的金属络合物中。而简并性是在电子占据不同简并的轨道却可能有相同或相近的能量时产生。 配体的作用类似路易斯碱,可以给金属提供电子,过渡金属通过d轨道和配体发生相互作用形成含d轨道的金属配合物。八面体配合物中,6个M-L键的长度相等。 八面体配合物中,5个d轨道可以分成两类,t2g(包括轨道 dxy, dzx 和 dxy)以及 eg (包括轨道 dz2 和 dx2-y2)。t2g 和 eg 轨道的能量分别是相同的(就是说 t2g 三个轨道的能量是相同的,eg 以此类推),其中 eg 轨道的能量比 t2g 轨道的要高一些。ΔO(配体场分裂参数)用于具体的能量差。在 ΔO 比电子成对能大的配合物中,电子倾向于成对,电子按能量从低到高的顺序占据d轨道。在这样一种低自旋的态中,t2g 轨道被占据满了后电子才会去占据 eg 轨道。而在高自旋配合物中,ΔO 比电子成对能小,eg 轨道中的每个轨道在 t2g 轨道中的任一个占满两个电子之前将分别占据一个电子。 在八面体配合物中,姜-泰勒效应在奇数个电子占据 eg 轨道时最常为被我们观察到。如,低自旋配合物中金属上的电子为7或9时(也就是 d7 和 d9)或有有一个单 eg 电子的高自旋配合物,d4。因此 d9 构型的Cu(II) 配合物常会出现姜-泰勒效应,比如本应为正八面体构型,但实际上为伸长(或缩短)八面体构型的 2+ 离子。 需要注意的是姜-泰勒效应并不能预测变形的方向,只能预测存在一个不稳定的构型。 在试验上,姜-泰勒效应可以通过无机化合物的紫外-可见光谱来研究和解释。 姜-泰勒效应在有机化学中也有应用。.
新!!: 配合物和姜-泰勒效应 · 查看更多 »
官能团
官能团(英文:Functional group),是决定有机化合物的化学性质的原子和原子团。.
对映异构
對映異構體(Enantiomer),又稱對掌異構物、光學異構物、鏡像異構物或对映异构体或旋光异构体,不能與彼此立體異構體鏡像完全重疊。 互為鏡像(mirror images)的分子。不对称碳原子和四種不同的原子或原子基團連結,不對稱碳為手性中心。當有n個手性中心時,則最多有2的n次方立體異構物。 來源於希臘文,具有左手對右手那樣鏡像關係的一對物質。無論怎樣擺佈都不能使這些鏡像成為同一物。有對稱平面的物質不能是對映體,因為它和它的鏡像是等同的。乳酸那樣的分子對映體,除了與其他不對稱分子的化學反應以及與偏振光作用外,具有完全相同的化學物質。對映體在結晶學中很重要,因為許多晶體是由單個分子的右手型和左手型交替排列的。對晶體的完整描述,就是要說明這些型體彼此間是如何混合的。兩種光學活性的酒石酸,即所謂d-酒石酸和l-酒石酸就是一對對映體的實例。.
三苯基膦
三苯基膦,分子式(C6H5)3P,白色固体,是磷化氢的三苯(苯、甲苯、二甲苯)取代物。主要表现为还原性和亲核性。在有机合成中有相当广泛的应用。.
一氧化碳
一氧化碳,分子式CO,是無色、無嗅、無味的无机化合物氣體,比空氣略輕。在水中的溶解度甚低,但易溶于氨水。空气混合爆炸极限为12.5%~74%。 一氧化碳是含碳物质不完全燃烧的产物。也可以作为燃料使用,煤和水在高温下可以生成水煤气(一氧化碳与氢气的混合物)。有些現代技術,如煉鐵,還是會產生副產品的一氧化碳。一氧化碳是可用作身體自然調節炎症反應的三種氣體之一(其他兩種是一氧化氮和硫化氫)。 由于一氧化碳与体内血红蛋白的亲和力比氧与血红蛋白的亲和力大200-300倍,而碳氧血红蛋白较氧合血红蛋白的解离速度慢3600倍,当一氧化碳浓度在空气中达到35ppm,就会对人体产生损害,會造成一氧化碳中毒(又称煤气中毒)。 雖然一氧化碳有毒,但動物代謝亦會產生少量一氧化碳,並認為有一些正常的生理功能。.
丙烷
丙烷是一个三碳的烷烃,化学式为,通常为气态,但一般经过压缩成液态后运输。原油或天然气处理后,可以从成品油中得到丙烷。丙烷通常用来作为发动机、烧烤食品及家用取暖系统的燃料。 在销售中,丙烷一般被称为液化石油气,其中也混有少量的丙烯、丁烷和丁烯。为了便于发现意外泄露,商用液化石油气中一般也加入恶臭的乙硫醇。.
乙二胺
乙二胺(作為配體時簡稱為en)是化學式為 C2H4(NH2)2 的有機化合物。乙二胺是一種胺類,為無色的鹼性液體,有類似氨的臭味。2008年乙二胺的使用量約500,000,000公斤。Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim.
乙二胺四乙酸
乙二胺四乙酸(Ethylenediaminetetraacetic acid),常缩写为EDTA,是一种有机化合物。它是一個六齿配體,可以螯著多種金屬離子。它的4個酸和2個胺的部分都可作為配體的齿,與錳(II)、銅(II)、鐵(III)及鈷(II)等金屬離子組成螯合物。.
新!!: 配合物和乙二胺四乙酸 · 查看更多 »
乙烯
乙烯是由两个碳原子和四个氢原子组成的化合物。两个碳原子之间用双键连接。 乙烯為合成纖維、合成橡膠、合成塑料(聚乙烯及聚氯乙烯)、合成乙醇(酒精)的基本化工原料,也用於制造氯乙烯、苯乙烯、環氧乙烷、醋酸、乙醛、乙醇和炸藥等,且可用作水果和蔬菜的催熟剂,是一種已證實的植物激素,也是石油化工發展水準之指標。.
亚硝酸盐
亚硝酸盐(Nitrite,NO2−)是亚硝酸成的盐,主要指亚硝酸钠(NaNO2),含有亚硝酸根离子,化學式NO2−,有一對稱陰離子與同等的N–O鍵長和大約120度的O–N–O鍵角。亞硝酸鹽可被氧化或還原,該產品一定程度上取決於氧化劑/還原劑和其強度。亞硝酸鹽也是重要生物化學作為強效血管擴張劑的一氧化氮(NO)的來源。在有機化學的NO2基團存在於亞硝酸酯和硝基化合物。亞硝酸鹽也可用於食品生產行業,用於醃肉保存肉品,和二級胺作用產生的硝酸胺长期食用可導致人類致癌,属于对人体健康有害的物质。 亚硝酸成的酯称为亚硝酸酯。某些细菌可将亚硝酸盐还原为一氧化氮或氨,另一些细菌可以将亚硝酸盐转换成硝酸盐。非直线型的亚硝酸根离子与臭氧是等电子体。.
亨利·陶布
亨利·陶布(Henry Taube,),化學家。他的研究興趣是氧化還原反應,其中对金属配位化合物电子转移机理的研究更使得他獲1983年諾貝爾化學獎。.
亲核取代反应
親核取代反應,或称亲核性取代反应,親核攻擊,通常發生在帶有正電或部份正電荷的碳上,碳原子與帶有負電或部份負電的親核试剂(Nu:−)產生反應而被取代。常分為兩種反應機構:.
新!!: 配合物和亲核取代反应 · 查看更多 »
二十面体
在幾何學中,二十面體(icosahedron)是指具有二十個面的多面體。正二十面體是五種正多面體之一,因此,名稱明確為正二十面體。然而,在化學中,二十面體主要指的是正二十面體。 在二十面體中,有些屬於半正多面體但非阿基米德立體,例如:正九角反稜柱、正十八角柱。 二十面體可以是正二十面體、十九角錐、十八角柱、九角反稜柱、雙十角錐、十方偏方面體、正三角台塔反角柱、同相和異相雙三角台塔柱等多面體等。.
二聚體
二聚体(Dimer)或稱双体、二聚物在不同領域中有不同意義,但基本涵義都表示相同或同一種類的物質,以成雙的型態出現,可能具有單一狀態時沒有的性質或功能。 化學上,凡是两个分子结合成一个新的物质,无论是物理作用还是化学变化,都可以将生成的物质称为二聚体。常见的例子包括二聚氯化亚铜、二聚氯化铝、二乙烯酮、气态的二聚羧酸、二聚环戊二烯、二聚环丁二烯等等,它可以是聚合物中的一種特例。蔗糖由葡萄糖和果糖单元縮合而成,則蔗糖雖為一個分子,仍歸屬為一種二聚体。.
五羰基铁
五羰基铁,铁与羰基的化合物,化学式为Fe(CO)5。.
应用化学 (期刊)
《应用化学》(Angewandte Chemie)是一本涵盖化学所有方面的同行评审科学期刊,每周出版一期。2011年,该刊的影响因子为13.455,它是发表原创研究的化学期刊中影响因子最高的;2013年被被美国化学会志(IF.
新!!: 配合物和应用化学 (期刊) · 查看更多 »
价键理论
价键理论(Valence bond theory,VB理论)是一种获得薛定谔方程近似解的处理方法,又称为电子配对法。价键理论与分子轨道理论是研究分子体系的两种量子力学方法。它是历史上最早发展起来的处理多个化学键分子的量子力学理论。价键理论主要描述分子中的共价键及共价结合,核心思想是电子配对形成定域化学键。.
位阻效应
位阻效应(也叫空间效应、空间位阻效应、立体效应)是研究分子中不同基团间電子團重疊形成的電磁力而造成的分子结构或反应取向的立体化学分枝。广泛应用于有机化学中分子结构及反应机理的定性讨论,但在有些情况下可能导致偏差或谬误。 Category:立体化学 Category:物理有机化学.
化合物
化合物(Chemical compound)是由兩種以上的元素以固定的質量比通过化學鍵结合在一起的化學物質。化合物可以由化學反應分解為更簡單的化學物質。像甲烷(CH4)、葡萄糖(C6H12O6)、硫酸鉛(PbSO4)及二氧化碳(CO2)都是化合物。 化合物是純物質分类下的一类,与元素和混合物相对。尽管有些情况下化合物的实际情况会与上述定义背离,如组成元素随制备方法而改变,内部结构并不均一,不同核素的分布并不固定等等,但一般仍认为它们属于化合物的范畴。另外,化合物中各元素的摩尔比并不一定是整数,某一元素也可呈不同的价态,例如非整比化合物和混合价态化合物。 化學元素的單質即使由幾個原子形成雙原子分子或多原子分子(如H2, S8),也不是化合物。 除特别不活泼的稀有气体氦和氖外,其他所有稳定元素都已制成了化合物。稀有气体化合物的制备曾费了一些周折。第一個稀有气体化合物六氟合铂酸氙是在1962年才製備而得。.
化学学会会刊
化学学会会刊(Journal of the Chemical Society)是一种科学期刊。是由英国皇家化学会从1862年开始发行。现时,有很多期刊的名字中包含有“化学学会会刊”字样。.
新!!: 配合物和化学学会会刊 · 查看更多 »
化学式
化學式(chemische Formel/chemical formula),是一種用來表示化學物質(也可能為元素或化合物)組成的式子。 一般情況下,由元素符號、數字或其他符號組成;這些符號單一行列,被限制在一個排版,並會出現上標和下標。 下為常用符號:.
化学键
化學鍵(Chemical Bond)是一種粒子間的吸引力,其中粒子可以是原子或分子。透過化學鍵,粒子可組成多原子的化學物質。鍵由兩相反電荷間的電磁力引起,電荷可能來自電子和原子核,或由偶極子造成。化學鍵種類繁多,其能量大小、鍵長亦有所不同。 在原子中,帶負電、繞原子核運行的電子與核內帶正電的質子互相吸引,而位於兩原子核之間的電子則皆受兩方吸引。因此,原子核和電子間最穩定的組態,是當電子位處兩原子核間之時。這些電子使原子核能夠彼此相吸,形成所謂的化學鍵。然而,化學鍵並不能減少個別粒子所構成的體積。由於電子的質量較小且具有物質波性質,它們相較於原子核而言佔據了極大部分的體積,使原子核之間距離較遠。 一般而言,強化學鍵的形成伴隨著原子間電子的共用或轉移。分子、晶體、金屬和雙原子氣體,事實上幾乎生活中所有外在環境,都是由化學鍵所維繫而來;它決定了物質的結構。.
化学性质
化学性质是物质在化學反應中表现出来的特徵及性质。.
包合物
在中,包合物是指由兩個化合物結合而成的一個複合物,其中一個化合物(主)形成一個空腔,而空腔裡面存在另一個化合物(客)。包合物的定義很明確,由化合物(主)晶體內提供一個由中間分子組成且符合化合物(客)的通道。若是化合物(主)晶體的內空間全面地封鎖住時,使化合物(客)看起來就好像被關在籠子內的樣子,也就是所謂的絡合物。.
分子生物学
分子生物学(Molecular biology)是对生物在分子層次上的研究。这是一门生物学和化学之间跨学科的研究,其研究领域涵盖了遗传学、生物化学和生物物理学等学科。分子生物学主要致力于对细胞中不同系统之间相互作用的理解,包括DNA,RNA和蛋白质生物合成之间的关系以及了解它们之间的相互作用是如何被调控的。.
分子轨道理论
分子轨道理论(),簡稱MO理论,是处理双原子分子及多原子分子结构的一种有效的近似方法,是化学键理论的重要内容。它与价键理论不同,后者着重于用原子轨道的重组杂化成键来理解化学,而前者则注重于分子轨道的了解,即认为分子中的电子围绕整个分子运动。 计算化学中常以原子轨道线性组合近似来计算分子轨道波函数: 式中的cij系数可由将等式代入薛定谔方程以及应用变分原理求得。简单地讲,该方法意即,分子轨道由原子轨道组合而成。原子轨道波函数各乘以某一系数相加或相减,得到分子轨道波函数。组合时原子轨道对分子轨道的贡献体现在系数上,组合前后轨道总数不变。 利用分子轨道理论与价键理论通常只是从一个问题的两个方面去看问题,常常会得到相同的结论。只是有时分子轨道理论的思想与计算过于复杂,在研究简单问题时,价键理论反而更显得简单明了。或者说,价键理论对于分子定态的性质(键长,键角等)的解释和分子轨道理论相近,而分子轨道理论在研究和电子激发相关的性质时(分子颜色,光电子能谱等)更为有效。.
新!!: 配合物和分子轨道理论 · 查看更多 »
分子量
分子量,又称“相对分子质量”,指组成分子的所有原子的原子量的总和,分子量的符号为Mr。定义为物质分子或特定单元的平均质量与12C质量的1/12之比值。由于是相对值,所以为无量纲量,单位为1。.
催化
催化是利用催化剂改变化学反应速度的一种工艺。许多化学工业要利用催化作用来获得需要的反应速度。催化也是一种化工单元过程,催化剂本身在反应中不会被消耗,但催化剂会改变反应速度,一催化劑亦可能參與複數的催化反應。正催化劑可加速反應;負催化劑或抑制劑則會與反應物反應進而降低化學反應。可提高催化劑活性的物質稱為促進劑;降低催化劑活性者則稱為催化毒。 相較於未催化的反應,同溫度的催化反應擁有較低的活化能。催化劑可以藉由結合反應物達到極化的效果,如酸催化劑之於羰基化合物的合成;催化劑也可產生非自然的反應中間物,如以四氧化鋨催化烯烴的雙羥基化中產生的鋨酸鹽酯;催化劑亦可造成反應物的裂解,如製氫時產生的單原子氫。 很多物质都可以做催化剂,在无机物反应中,通常利用酸、碱、金属或金属化合物作为催化剂,在有机物反应中多用有性的蛋白质分子——酶作为催化剂,生物体内许多化学反应都依赖酶來进行的。 催化反应可以发生在单相和多相中,也可以发生在复相中:.
催化剂
催化劑又稱觸媒,是能透過提供另一活化能較低的反應途徑而加快化學反應速率,而本身的質量、組成和化學性質在參加化學反應前後保持不變的物質。例如二氧化錳可以作為過氧化氫(雙氧水)分解的催化劑。與催化劑相反,能減慢反應速率的物質稱為抑制劑。過去曾用的「負催化劑」一詞已不被國際純粹與應用化學聯合會所接受,而必須改用抑制劑一詞,催化劑一詞僅指能加快反應速率的物質。.
哈普托數
哈普托數(英文hapticity)是說明在配體中一群相連的原子如何和中心原子配位。配體的hapticity會用希臘字母η來表示,η上標的數字表示配體中有幾個相連的原子和中心原子配位。一般來說上述的標示只適用在不只一個原子參與配位的情形。 如二茂鐵中環戊二烯(Cp)有五個原子參與鍵結,因此其哈普托數為5。 在有機金屬化學中,常用哈普托數來標示有機的配體如何和中心金屬配位。 Category:配位化學 Category:有機金屬化學.
八面體
在幾何學中,八面體是指由八個面組成的多面體,而由八個全等的正三角形組成的八面體稱為正八面體。其中正八面體是八面體中頂點和邊數最少的多面體,一些八面體可能有超過12個頂點和18條邊。在八面體中亦有一種星形多面體,即星形八面體 。.
共价键
共价键(Covalent Bond),是化学键的一种。两个或多个非金屬原子共同使用它们的外层电子(砷化鎵為例外),在理想情况下达到电子饱和的状态,由此组成比较稳定和坚固的化学结构叫做共价键。与离子键不同的是进入共价键的原子向外不显示电荷,因为它们并没有获得或损失电子。共价键的强度比氢键要强,比离子键小。 同一種元素的原子或不同元素的原子都可以通過共價鍵結合,一般共價鍵結合的產物是分子,在少數情況下也可以形成晶體。 吉爾伯特·路易斯于1916年最先提出共价键。 在简单的原子轨道模型中进入共价键的原子互相提供单一的电子形成电子对,这些电子对围绕进入共价键的原子而属它们共有。 在量子力学中,最早的共价键形成的解释是由电子的复合而构成完整的轨道来解释的。第一个量子力学的共价键模型是1927年提出的,当时人们还只能计算最简单的共价键:氢气分子的共价键。今天的计算表明,当原子相互之间的距离非常近时,它们的电子轨道会互相之间相互作用而形成整个分子共用的电子轨道。.
光谱化学序列
光谱化学序列由(紫外-可见)光谱得到,用以表示配体和金属离子对分裂能 Δ 的影响大小,主要应用在晶体场理论和配位场理论中。分裂能是1个电子从较低能量d轨道跃迁到较高能量d轨道所需的能量。 光谱化学序列可以解释一些化合物的颜色差异。常见配体在光谱化学序列中的顺序列在下面,分裂能从小到大: I− − 2− − − 3− 3− − − 2O42− ≈ H2O − 3CN 3 2− 3 − ≈ CO H2O 左边的配体称为弱场配体,右边的称为强场配体。 金属离子相同时,分裂能从小到大:.
新!!: 配合物和光谱化学序列 · 查看更多 »
四羰基镍
四羰基镍,或称羰基镍、四羰基合镍,是一个有机金属配合物,分子式为Ni(CO)4。1890年首先由路德维希·蒙德(Ludwig Mond)制得,是第一个合成的简单金属羰基配合物。室温下四羰基镍为无色液体,易挥发,毒性极大。.
四角錐
四角錐是底面為四邊形的錐體。.
四方反棱柱体
#重定向 四角反棱柱.
新!!: 配合物和四方反棱柱体 · 查看更多 »
砷化鎵
砷化鎵(化學式:GaAs)是鎵和砷兩種元素所合成的化合物,也是重要的IIIA族、VA族化合物半导体材料,用來製作微波積體電路、紅外線發光二極體、半导体激光器和太陽電池等元件。.
硝酸盐
硝酸鹽是一個多原子離子其分子式NO3−和分子量62.0049克/mol。硝酸鹽同樣描述為有機官能團RONO2。這些硝酸酯是一專業炸藥。 CP#3是硝酸根离子NO3−形成的盐。许多金属都能形成硝酸盐,包括无水盐或水合物。.
硫酸鹽
硫酸盐,由硫酸根离子()与其他金属离子组成的化合物,幾乎都是电解质,且大多数溶于水。.
硫酸铜
硫酸铜,又稱藍礬,化学式CuSO4,無水為白色粉末,含水为藍色粉末,或因不纯而呈淡灰绿色,是可溶性铜盐。硫酸铜常见的形态为其结晶体,一水合硫酸四水合铜([Cu(H2O)4]SO4·H2O,五水合硫酸铜),为蓝色固体。其水溶液因水合铜离子的缘故而呈现出蓝色,故在实验室里无水硫酸铜常被用于检验水的存在。在现实生产生活中,硫酸铜常用于炼制精铜,與熟石灰混合可製农药波尔多液。硫酸铜属于重金属盐,有毒,成人致死剂量0.9g/kg。若误食,应立即大量食用或飲用牛奶、鸡蛋清等富含蛋白质食品,或者使用EDTA钙钠盐解毒。.
硫氰酸盐
硫氰酸盐是硫氰酸根离子SCN−所成的盐,常见的包括无色的硫氰酸钾、硫氰酸钠、硫氰酸铵和硫氰酸汞。 硫氰酸酯指含有SCN官能团的有机化合物。 硫氰酸根离子与氰酸根离子−同类,只是氧原子被硫原子替代。−与卤离子相似之处很多,是拟卤离子之一。 硫氰酸盐可由硫或硫代硫酸盐与氰化物反应制备: +S8->8SCN- +S2O3^2- ->SCN- +SO3^2- 磺基转移酶硫氰酸酶可催化第二个反应,可能是体内氰化物解毒的机理。 Riemschneider硫代氨基甲酸酯合成涉及有机硫氰酸酯水解为硫代氨基甲酸酯的反应。.
硬水软化
水软化是降低水硬度的操作,可以将硬水软化为软水。硬水软化可以提高水使用的安全性。.
磁
磁是一种物理现象,磁学是研究磁现象的一个物理学分支,磁性是物質響應磁場作用的性质。磁性表现在順磁性物質或铁磁性物質(如铁钉)會趨向於朝著磁場較強的區域移動,即被磁場吸引;反磁性物質則會趨向於朝著磁場較弱的區域移動,即被磁場排斥;還有一些物質(如自旋玻璃、反鐵磁性等)會與磁場有更複雜的關係。 依照溫度、壓強等參數的不同,物質會顯示出不同的磁性。表现出磁性的物质通称为磁体,原来不具有磁性的物质获得磁性的过程称为磁化,反之称为退磁。磁鐵本身會產生磁場,但本质上磁场是由电荷运动產生,如磁铁内部未配對电子的自旋,会产生磁场,当这些磁场的方向一致时,宏观上就表现为磁性。.
磷化氢
磷化氢,又名膦,分子式:,一种无色、极毒、有魚腥臭味的气体。.
离子
離子是指原子或原子基团失去或得到一个或几个电子而形成的带电荷的粒子。得失电子的过程称为电离,电离过程的能量变化可以用电离能来衡量。 在化学反应中,通常是金属元素原子失去最外层电子,非金属原子得到电子,从而使参加反应的原子或原子团带上电荷。带正电荷的原子叫做阳离子,带负电荷的原子叫做阴离子。通过阴、阳离子由于静电作用结合而形成不带电性的化合物,叫做离子化合物。 与分子、原子一样,离子也是构成物质的基本粒子。如氯化钠就是由氯离子和钠离子构成的。.
离子键
离子键又被称为盐键,是化学键的一种,通过两个或多个原子或化学基团失去或获得电子而成为离子后形成。带相反电荷的原子或基团之间存在静电吸引力,两个带相反电荷的原子或基团靠近时,周围水分子被释放为自由水中,带负电和带正电的原子或基团之间产生的静电吸引力以形成离子键。 此类化学键往往在金属与非金属间形成。失去电子的往往是金属元素的原子,而获得电子的往往是非金属元素的原子。带有相反电荷的离子因电磁力而相互吸引,从而形成化学键。离子键较氢键强,其强度与共价键接近。 仅当总体的能级下降的时候,反应才会发生(由化学键联接的原子较自由原子有着较低的能级)。下降越多,形成的键越强。 现实中,原子间并不形成“纯”离子键。所有的键都或多或少带有共价键的成分。成键原子之间电平均程度越高,离子键成分越低。.
立体异构
立体异构体(stereoisomerism),根据IUPAC金色书的定义是指具有相同原子连接顺序,但原子在空间排列不相同的同分异构体。这种异构现象称为立体异构。具有不同光学性质的立体异构体又称光学异构体,但“光学异构”一词是IUPAC不推荐的用法。 以前将立体异构划分为几何异构、旋光异构和构象异构三类,但目前较好的分类是将其分为对映异构和非对映异构两类,其中非对映异构又包括顺反异构(即几何异构)和构象异构。.
立方體
立方體(Cube),是由6個正方形面組成的正多面體,故又稱正六面體(Hexahedron)、正方體或正立方體。它有12條稜(邊)和8個頂(點),是五個柏拉圖立體之一。 立方體是一種特殊的正四棱柱、長方體、三角偏方面體、菱形多面體、平行六面體,就如同正方形是特殊的矩形、菱形、平行四邊形一様。立方體具有,即考克斯特BC3對稱性,施萊夫利符號,,與正八面體對偶。.
简并
#重定向 简并能级.
簇合物
#重定向 原子簇.
线性组合
線性組合(Linear combination)是線性代數中具有如下形式的表达式。其中v_i为任意类型的项,a_i为标量。這些純量稱為線性組合的係數或權。.
经线
经线也称子午线,和緯線一樣是人類為度量而假設出來的輔助線,定義為地球表面连接南北两极的大圆线上的半圆弧。任两根经线的长度相等,相交于南北两极点。每一根经线都有其相对应的数值,称为经度。经线指示南北方向。 子午线命名的由来:「某一天体视运动轨迹中,同一子午线上的各点该天体在上中天(午)与下中天(子)出现的时刻相同。」不同的经线具有不同的地方时。偏东的地方时要比较早,偏西的地方时要迟。.
结构异构
结构异构,也称构造异构,是指由于化合物具有不同的原子连接顺序而产生的同分异构现象,与立体异构相对。存在结构异构的化合物互称结构异构体。它们又可分为碳链异构、位置异构和官能团异构三类。.
羟基
基,又称氢氧基,化学式为–OH,是含有氧原子以共價鍵與氫原子連接的化學官能團,有時也稱為醇官能團,是常见的极性基团。羥基基團以共價鍵結合羰基(–C.
羰基
基(carbonyl group)在有机化学中,是一个形如 C.
热力学
热力学,全稱熱動力學(thermodynamique,Thermodynamik,thermodynamics,源於古希腊语θερμός及δύναμις)是研究热现象中物态转变和能量转换规律的学科;它着重研究物质的平衡状态以及与準平衡态的物理、化学过程。热力学定義許多巨觀的物理量(像溫度、內能、熵、壓強等),描述各物理量之間的關係。热力学描述數量非常多的微觀粒子的平均行為,其定律可以用統計力學推導而得。 熱力學可以總結為四條定律。 熱力學第零定律定義了温度這一物理量,指出了相互接觸的两个系統,熱流的方向。 熱力學第一定律指出内能這一物理量的存在,並且與系統整體運動的動能和系統与與環境相互作用的位能是不同的,區分出熱與功的轉換。 熱力學第二定律涉及的物理量是温度和熵。熵是研究不可逆过程引入的物理量,表征系統通過熱力學過程向外界最多可以做多少熱力學功。 熱力學第三定律認為,不可能透過有限過程使系統冷却到絕對零度。 熱力學可以應用在許多科學及工程的領域中,例如:引擎、相變化、化學反應、輸運現象甚至是黑洞。熱力學計算的結果不但對物理的其他領域很重要,對航空工程、航海工程、車輛工程、機械工程、細胞生物學、生物醫學工程、化學、化學工程及材料科學等科學技術領域也很重要,甚至也可以應用在經濟學中。 热力学是从18世纪末期发展起来的理论,主要是研究功與热量之間的能量轉換;在此功定義為力與位移的內積;而熱則定義為在熱力系統邊界中,由溫度之差所造成的能量傳遞。兩者都不是存在於熱力系統內的性質,而是在熱力過程中所產生的。 熱力學的研究一開始是為了提昇蒸汽引擎的效率,早期尼古拉·卡諾有許多的貢獻,他認為若引擎效率提昇,法國有可能贏得拿破崙戰爭。出生於愛爾蘭的英國科學家開爾文在1854年首次提出了熱力學明確的定義: 一開始熱力學研究關注在熱機中工質(如蒸氣)的熱力學性質,後來延伸到化学过程中的能量轉移,例如在1840年科學家杰迈因·亨利·盖斯提出,有關化學反應的能量轉移的研究。化學熱力學中研究熵對化學反應的影響Gibbs, Willard, J. (1876).
烯烃
(alkene)是指含有C.
烷基
烷基是一类仅含有碳、氢两种原子的链状有机官能团。它们是一系列同系物,其通式为CnH2n+1。常见的有甲基·(对应于甲烷)、乙基·(对应于乙烷)、丙基·(分为正丙基与异丙基)等。.
炔烃
(alkyne)是一类有机化合物,属于不饱和烃。其官能团为碳-碳三键(-C≡C-)。通式CnH2n-2,其中n為非1正整數。简单的炔烃化合物有乙炔(),丙炔()等。炔烃也被叫做电石气,电石气通常也被用来特指炔烃中最简单的乙炔。 炔字是新造字,左边的火取自“碳”字,表示可以燃烧;右边的夬取自“缺”字,表示氢原子数和化合价比烯烃更加缺少,意味着炔是烷(完整)和烯(稀少)的不饱和衍生物。「炔」的讀音同「缺」。.
生物学
生物学研究各種生命(上图) 大肠杆菌、瞪羚、(下图)大角金龟甲虫 、蕨類植物 生物學(βιολογία;biologia;德語、法語:biologie;biology)或稱生物科學(biological sciences)、生命科學(life sciences),是自然科學的一大門類,由經驗主義出發,廣泛研究生命的所有方面,包括生命起源、演化、分佈、構造、發育、功能、行為、與環境的互動關系,以及生物分類學等。現代生物學是一個龐大而兼收並蓄的領域,由許多分支和分支學科組成。然而,盡管生物學的範圍很廣,在它裡面有某些一般和統一概念支配一切的學習和研究,把它整合成單一的,和連貫的領域。在總體上,生物以細胞作為生命的基本單位,基因作為遺傳的基本單元,和進化是推動新物種的合成和創建的引擎。今天人們還了解,所有生物體的生存以消耗和轉換能量,調節體內環境以維持穩定的和重要的生命條件。 生物學分支學科被研究生物體的規模所定義,和研究它們使用的方法所定義:生物化學考察生命的基本化學;分子生物學研究生物分子之間錯綜復雜的關系;植物學研究植物的生物學;細胞生物學檢查所有生命的基本組成單位,細胞;生理學檢查組織,器官,和生物體的器官系統的物理和化學的功能;進化生物學考察了生命的多樣性的產生過程;和生態學考察生物在其環境如何相互作用。最終能夠達到治療診斷遺傳病、提高農作物產量、改善人類生活、保護環境等目的。.
生物无机化学
生物无机化学是研究金屬在生物體內角色的學科,生物无机化学研究像金属蛋白及金属酶等天然的生物分子,金属与生物分子的相互作用,如金属离子通道,也研究在醫藥(金属药物)及毒物學中,金屬(特別是非膳食礦物質)對生物的影響。生物无机化学也包括金属蛋白的模型研究及仿真 生物无机化学是无机化学与生物化学的交叉学科,像電子轉移蛋白質、受體的鍵結及活化,原子和原子團的轉移,以及生物化学中的金属性质。許多(像呼吸作用)也和許多無機化合物有關。.
新!!: 配合物和生物无机化学 · 查看更多 »
电子排布
電子排序,即電子組態,亦即電子構型,指電子在原子、分子或其他物理結構中的每一層電子層上的排序及排列形態。 正如其他基本粒子,電子遵從量子物理學,而不是一般的經典物理學;電子也因此有波粒二象性。而且,根據量子物理學中的《哥本哈根詮釋》,任一特定電子的確實位置是不會知道的(軌域及軌跡放到一旁不計),直至偵測活動進行使電子被偵測到。在空間中,該測量將會檢測的電子在某一特定點的概率,和在這一點上的波函數的絕對值的平方成正比。 電子能夠由發射或吸收一個量子的能量從一個能級跃迁到另一個能級,其形式是一個光子。由於泡利不相容原理,沒有兩個以上的電子可以存在於某個原子軌域(軌域不等於電子層);因此,一個電子只可跨越到另有空缺位置的軌域。 知道不同的原子的電子構型有助了解元素週期表中的元素的結構。這個概念也有用於描述約束原子的多個化學鍵。在散裝物料的研究中這一理念可以說明激光器和半導體的奇特性能。.
电子效应
电子效应,理论有机化学基本概念之一。细分为两大类:一类是涉及π键的共轭效应;一类是涉及σ键的诱导效应和超共轭效应。 电子效应本质上来讲就是由于不同原子之间存在电负性的差别,这个差别导致了化学键的极化。这种极化的结果可以沿着化学键传导,从而对分子本身的物理性质和化学性质产生了影响。.
电导
電導(electrical conductance)是表示一個物體或電路,從某一點到另外一點,傳輸電流能力強弱的一種測量值,與物體的電導率和幾何形狀和尺寸有關。 现在国际单位制对这个数值的单位为西门子(Siemens,缩写“S”)。在过去,电导的单位为「姆歐」(Mho,由Ohm即欧姆这个词的字母顺序颠倒而得,或以上下颠倒的Ω来表示)。.
物理性质
物理性质是物质不需要发生化学变化就表现出来的性质。這些性質是能被感現感知或利用儀器測知的。.
癌症
症(英語:Cancer)又名為腫瘤(英語:Malignant tumor),指的是細胞不正常增生,且這些增生的細胞可能侵犯身體的其他部分;中医学中称岩,為由控制細胞分裂增殖机制失常而引起的疾病。癌细胞除了分裂失控外,还会週遭正常組織甚至經由体内循環系統或淋巴系統转移到身體其他部分。不是所有的腫瘤都會癌化,有些細胞增生不會侵犯身體其他部分,稱為良性腫瘤。癌症常見的徵象與症狀包括新發生的腫塊、異常的出血、慢性咳嗽、無法解釋的體重減輕、以及腸胃蠕動的改變等等,但其他疾病也可能會出現這些症狀,因此發現這些症狀並不一定表示得了癌症。在人類身上,目前已知的癌症超過一百種。 癌症有許多類型,因吸菸而罹癌者佔了癌症死者中的22%,肥胖、飲食不佳、運動不足、飲酒則共佔了10%。其他可能造成癌症的因素還包括某些感染、暴露於游離輻射、以及環境汙染因子。在發展中國家約有20%的癌症是由於感染症(如B型肝炎、C型肝炎、以及人類乳突病毒等)造成。致癌因子通常是透過改變細胞中的遺傳物質運作,通常許多這類遺傳物質的變化是癌症產生所必要的。約5-10%的癌症是由於遺傳自雙親的基因異常。癌症可以由症狀和徵候或透過的方式發現,然後再以影像檢查和切片檢查來確診。癌細胞持續生長而不受外在訊息調控,可能是原本正常的原癌基因被激活,将细胞引入到癌变状态,但主要还是因为一些与控制細胞分裂有关的蛋白质出现異常,如腫瘤抑制基因的功能失常。导致这种局面,可能是为该蛋白编码的DNA因突变而出现了损伤,轉译而出的蛋白质因此也出现错误。要將一個正常細胞轉化成一個惡性腫瘤細胞通常需要許多次突變,或是基因轉譯為蛋白質的过程受到干扰。引起基因突變的物质被稱為致癌物質,又以其造成基因損傷的方式可分為化學性致癌物與物理性致癌物。例如接觸放射性物質,或是一些環境因子,例如,香煙、輻射、酒精。还有一些病毒可將本身的基因插入細胞的基因裡,激活癌基因。但突变也会自然產生,所以即使避免接觸上述的致癌因子,仍然無法完全預防癌症的產生。发生在生殖细胞的突变有可能傳至下一代。 許多癌症都可以預防,預防的方式包括戒烟、不要攝取太多酒精、多吃蔬菜水果及類食品、減少紅肉與速食(包含)的攝取、維持健康體重、多運動、減少陽光曝曬、以及施打疫苗預防某些感染症等等。透過篩檢早期發現,對於部分的癌症(包括大腸直腸癌和子宮頸癌等)有用,但乳癌篩檢的價值則有爭議性。對癌症的治療方式通常結合化學療法、放射療法、手術以及標靶治療等。疼痛控制與症狀控制是癌症治療中重要的一環,而安寧緩和醫療對於癌症晚期的病人來說相當重要。癌症病人的存活率端看癌症的種類與開始治療時的疾病狀況。在已開發國家兒童癌症病人的五年存活率平均高達80%,在美國的成年癌症病人的平均五年存活率則有66%。而病症的嚴重程度取決於癌細胞所在部位以及惡性生長的程度。多數癌症根據其類型、所處的部位和發展的階段可以治療甚至治癒。一旦診斷確定,癌症通常以結合手術、化療和放射療法的方式進行治療。隨著科學研究的進步,開發出許多針對特定類型癌症的藥物,也增進治療上的效果。如果癌症未經治療,通常最終結果將導致死亡,也有出現因癌症未及時治療或是改用另類療法而延誤正規治療,因此影響病情的情形。 在2012年,大約有1,410萬人得到癌症,並且造成820萬人身亡(相當於全年總死亡人數的14.6%)。男性身上最常見的癌症包括肺癌、前列腺癌(攝護腺癌)、大腸直腸癌、以及胃癌;在女性身上最常見的則是乳癌、大腸直腸癌、肺癌和子宮頸癌。兒童以急性淋巴性白血病和腦瘤最常見,不過非洲除外,非何杰金氏淋巴瘤在那裡更常見。2012年,大約16.5萬個15歲以下的兒童被診斷出罹患癌症。各個年齡層的人都有可能產生癌症,由於DNA的損傷會隨著年齡而累積增加,罹癌的風險會隨著年齡的增長而升高,同時有數種癌症在已開發國家較常見。美国每年逝世的5个人当中有一人是因癌症致死,这一数字在世界范围则是100-350/100000。癌症在发达国家中已成為主要死亡原因之一,在台灣則是長年位居十大死因之首。隨著人類越來越長壽及開發中國家生活習慣的改變,全球的罹癌率整體而言在上升中。.
芳香环
芳香环是一类有机芳香化合物。 芳香环拥有共轭的平面环体系,原子间成键并不是不连续的单双键交替,而是被离域π电子云覆盖。典型的芳香环化合物是苯和吲哚。.
銀
银(silver)是一种化学元素,化学符号Ag(来自argentum),原子序数47。银是一种柔软有白色光泽的过渡金属,在所有金属中导电率、导热率和反射率最高。銀在自然界中的存在方式有纯净的游离态单质(自然银),与金等其他金属的合金,还有含银矿石(如辉银矿和角银矿)。大部分银都是精炼铜、金、铅和锌的副产品。 银不易受化學藥品腐蝕,长久以来被视为贵金属。银比金来源更丰富,在现代以前的货币体系中作为硬币使用,有时甚至和金一道使用。除了货币之外,银的用途还有太阳能电池板、净水器、珠宝和装饰品、高价餐具和器皿(银器),银币和还可用于投资。银在工业上用于和导体、特制镜子、窗膜和化学反应的催化剂。银的化合物用于胶片和X光。稀硝酸银溶液等银化合物会产生,可以消毒和消灭微生物,用于绷带、伤口敷料、导管等医疗器械。.
螯合物
螯合物(Chelation)是配合物的一种,在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。“螯”指螃蟹的大钳,此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。 螯合物通常比一般配合物要稳定,其结构中经常具有的五或六元环结构更增强了稳定性。正因为这样,螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。使用螯合物还可以掩蔽金属离子。 可形成螯合物的配体叫螯合剂。常见的螯合剂如下:.
聚合
聚合是将一种或几种具有简单小分子的物质,合并成具有大分子量的物质的化工单元过程。 大分子量的物质一般叫作聚合物或高分子化合物,分子量都高达几千甚至几百万。淀粉、纤维素都是天然的高聚物,是由单糖聚合而成的。塑料是人工合成的高聚物。能够聚合成高聚物的小分子物质叫做单体,单体一般有三类:一种是含有不饱和键,大部分是碳碳双键,也可能是碳碳三键或者是碳氮三键;另一种单体是含有两个或多个有特殊功能的原子团;第三种单体是不同原子组成的环状分子,比如碳氧环、氧硫环、碳氮环等。这些单体可以互相连接形成高聚物。 如果聚合是由同一种单体进行的叫做均聚;如果由几种不同的单体形成高聚物,叫做共聚。 例如由乙烯分子作为单体聚合形成聚乙烯塑料的过程就叫做均聚;此外还有丙烯均聚形成聚丙烯塑料,氯乙烯形成聚氯乙烯等。 有乙烯和丙烯进行共聚,可以形成合成橡胶,叫做乙丙橡胶。 任何小分子合并的过程都可以叫做聚合,不仅仅是必须形成高聚物。例如三个甲醛分子合成一个三聚甲醛分子的过程也叫做聚合过程。.
联吡啶
联吡啶(bipyridine,常缩写为bipy、bpy 等)是一系列由两个吡啶分子偶联形成的杂环化合物的统称。该名称主要指:.
药物
药物(drug)广义上指可以对人或其他动物产生已知生物效应的物质 Merriam Webster: Concise Encyclopedia。食物通常不适用于这个定义,尽管它们也可以对生物物种产生生理效应 Dictionary.com Unabridged (v 1.1), Random House, Inc., via dictionary.com.
草酸盐
草酸盐是草酸形成的盐类,含有草酸根离子(C2O42−或(COO)22−)。由于草酸是二元酸,因此草酸盐分为正盐草酸盐与酸式盐草酸氢盐两类,后者含有HC2O4−。 草酸根离子(见右图)可作配体,与很多金属离子形成配合物,尤其是螯合物。该离子中,含有一个平面的八电子π体系,电子稳定性特别突出。它属于还原性阴离子,可被氧化剂,如高锰酸钾氧化为二氧化碳。 草酸盐有毒,人吞食可能發生草酸盐中毒,导致肾脏疾病甚至死亡。草酸根离子可沉淀钙离子,生成不溶于水的草酸钙。.
草酸铁钾
草酸铁钾(化学式:K3),三水合物为翠绿色晶体,是一个含铁(III)的配合物,溶于水得到绿色溶液。主要用作光化剂。三个双齿的草酸根离子与铁形成八面体型配位,因此它有Λ-和Δ-两种异构体:.
萊納斯·鮑林
萊納斯·卡爾·鮑林(Linus Carl Pauling,),美國化学家,量子化學和結構生物學的先驱者之一。1954年因在化學鍵方面的工作取得诺贝尔化学奖,1963年因反對核彈在地面測試的行動获得1962年度的诺贝尔和平奖,成為获得不同诺贝尔奖项的兩人之一(另一人為居里夫人);也是唯一的一位每次都是独立地获得诺贝尔奖的获奖人。其後他主要的行動為支持維他命C在醫學的功用。鮑林被认为是20世纪对化学科学影响最大的人之一,他所撰写的《化学键的本质》被认为是化学史上最重要的著作之一。他以量子力學入手分析化學問題,結論卻以直觀、淺白的概念重新闡述,即便未受量子力學訓練的化學家亦可利用準確的直觀圖像研究化學問題,影響至為深遠,比如他所提出的許多概念:电负度、共振論、价键理论、混成軌域、蛋白质二級結構等概念和理论,如今已成為化学領域最基础和最广泛使用的觀念。 他晚年过度吹捧营养补充品的药用价值,并提倡使用高剂量的维生素C治疗感冒,给自己的声誉带来了负面影响。.
新!!: 配合物和萊納斯·鮑林 · 查看更多 »
静电
静电是电荷在物质系统中的不平衡分布产生的现象。用毛皮摩擦琥珀、丝绸摩擦玻璃棒等方法均能使物体带电。物体带电后,电荷会保持在物体上,除非被其他物体移走,所以称之为“静电”。静电与电流不同,后者是电荷在导体中的定向移动产生的电学现象。带电物体往往具有吸引轻小物体(比如纸屑)的性质。.
顺反异构
顺反异构(英文:Cis-trans isomerism),舊称几何异构,是存在于某些双键化合物或环状化合物中的一种立体异构现象。由于存在双键或环,这些分子的自由旋转受阻,产生两个物理性質或化學性質均不相同的同分异构体,分别称为顺式(cis)和反式(trans)异构体。 “顺式加成”指的是从双键/三键的同一侧进行加成;“反式加成”指的是从双键/三键的两侧进行加成。 在双键化合物中,若与两个双键原子相连的相同或相似的基团处在双键的同侧,则该化合物被称为“顺式”异构体;若两个基团处于异侧,则定义为“反式”异构体,比如右图所示的2-丁烯的两个同分异构体。 在环状化合物中,若两个相同的取代基位于环平面的同侧,则称该化合物为“顺式”;反之称为“反式”。例如下图的1,2-二氯环己烷的两个异构体: 由于顺式与反式异构体中原子的空间排列不同,它们的物理性质(如熔点、沸点、溶解度)和化学性质通常也有不同。一般来说,反式异构体比顺式异构体稳定。这是因为顺式异构体中两个相同基团处于同侧,可能造成偶极矩的叠加,增加不对称性,而反式异构体中两个基团以双键中心形成中心对称,所造成的影响可以相互抵消。但以上规则也不是绝对的,比如在有些1,2-二卤乙烯、1,2-二氟二氮烯(FN.
顺铂
顺铂(Cisplatin,CDDP)是一种含铂的抗癌药物,即顺式-二氯二氨合铂(II),棕黄色粉末,属于细胞周期非特异性药物,对肉瘤、恶性上皮肿瘤、淋巴瘤及生殖细胞肿瘤都有治疗功效。它是第一个合成铂类抗癌药物,结构简单,机理明确,并引发了对铂类药物研究的热潮,包括卡铂、奥沙利铂、奈达铂及赛特铂等。.
血紅素
血紅素在不同地區有不同含意,可以指:.
血红蛋白
血红蛋白,俗稱血色素,(Hemoglobin(美國) 或 haemoglobin(英國);縮寫︰Hb 或 Hgb)是高等生物体内负责运载氧的一种蛋白质。可以用平均細胞血紅蛋白濃度測出濃度。 血红蛋白存在于几乎所有的脊椎动物体内,在某些无脊椎动物组织也有分布。血液中的血红蛋白从呼吸器官中将氧气运输到身体其他部位释放,以满足机体氧化营养物质支持功能运转之需要,并将由此生成的二氧化碳带回呼吸器官中以排出体外。在哺乳动物中,血红蛋白占红细胞干重的97%、总重的35%。平均每克血红蛋白可结合1.34ml的氧气,是血浆溶氧量的70倍。一个哺乳动物血红蛋白分子可以结合最多四个氧分子。 血红蛋白也参与其他气体的转运:它能携带机体的部分二氧化碳(大约10%)。亦可将重要的调节分子一氧化氮结合在球状蛋白的某个硫醇基团上,在释放氧气的同时将其释放。 在红细胞及其祖系细胞以外也发现了血红蛋白——包括黑质中的A9多巴胺神经元、巨噬细胞、肺泡细胞以及肾脏中的系膜细胞。在这些组织中,血红蛋白作为抗氧化剂和铁代谢的调节因子存在。 血红蛋白和类血红蛋白分子在许多无脊椎动物、真菌和植物中也有分布。在这些机体中,血红蛋白可能携带氧气,抑或扮演转移和调节诸如二氧化碳、一氧化氮、硫化氢和硫化物的角色。其中一种称作豆血红蛋白(Leghemoglobin)的变体分子是用来清除氧气以免毒害诸如豆科植物的固氮根瘤的厌氧系统的。 血红蛋白化学式:C3032H4816O812N780S8Fe4。人体内的血红蛋白由四个亚基构成,分别为两个α亚基和两个β亚基,在与人体环境相似的电解质溶液中血红蛋白的四个亚基可以自动组装成α2β2的形态。 血红蛋白的每个亚基由一条肽链和一个血红素分子构成,肽链在生理条件下会盘绕折叠成球形,把血红素分子抱在里面,这条肽链盘绕成的球形结构又被称为珠蛋白。血红素分子是一个具有卟啉结构的小分子,在卟啉分子中心,由卟啉中四个吡咯环上的氮原子与一个亚铁离子配位结合,珠蛋白肽链中第8位的一个组氨酸残基中的吲哚侧链上的氮原子从卟啉分子平面的上方与亚铁离子配位结合,当血红蛋白不与氧结合的时候,有一个水分子从卟啉环下方与亚铁离子配位结合,而当血红蛋白载氧的时候,就由氧分子顶替水的位置。 血紅蛋白與氧的結合可受到2,3-二磷酸甘油酸(2,3-BPG)的調控,成人的血紅素組成為α2β2,使成人血紅蛋白對氧的親和性降低,而胎兒血紅蛋白的組成為α2γ2,不受2,3-二磷酸甘油酸影響。 血红蛋白与氧结合的过程是一个非常神奇的过程。首先一个O2与血红蛋白四个亚基中的一个结合,与氧结合之后的珠蛋白结构发生变化,造成整个血红蛋白结构的变化,这种变化使得第二个氧氣分子相比于第一个氧氣分子更容易寻找血红蛋白的另一个亚基结合,而它的结合会进一步促进第三个氧氣分子的结合,以此类推直到构成血红蛋白的四个亚基分别与四个氧氣分子结合。而在组织内释放氧的过程也是这样,一个氧氣分子的离去会刺激另一个的离去,直到完全释放所有的氧氣分子,这种有趣的现象称为协同效应。 由于协同效应,血红蛋白与氧气的结合曲线呈S形,在特定范围内随着环境中氧含量的变化,血红蛋白与氧分子的结合率有一个剧烈变化的过程,生物体内组织中的氧浓度和肺组织中的氧浓度恰好位于这一突变的两侧,因而在肺组织,血红蛋白可以充分地与氧结合,在体内其他部分则可以充分地释放所携带的氧分子。可是当环境中的氧气含量很高或者很低的时候,血红蛋白的氧结合曲线非常平缓。 除了运载氧,血红蛋白还可以与二氧化碳、一氧化碳、氰离子结合,结合的方式也与氧完全一样,所不同的只是结合的牢固程度,一氧化碳、氰离子一旦和血红蛋白结合就很难离开,这就是煤气中毒和氰化物中毒的原理,遇到这种情况可以使用其他与这些物质结合能力更强的物质来解毒,比如一氧化碳中毒可以用静脉注射亚甲基蓝的方法来救治。.
颜色
色或色彩是通过眼、脑和我们的生活经验所产生的一种对光的视觉效应。人对颜色的感觉不仅仅由光的物理性质所决定,還包含心理等許多因素,比如人类对颜色的感觉往往受到周围颜色的影响。有时人们也将物质产生不同颜色的物理特性直接称为颜色。.
解毒剂
解毒剂指可以解除毒性的物质。.
高锰酸盐
锰酸盐是高锰酸所形成的盐,含有四面体型的高锰酸根离子—MnO4−,其中锰的氧化态为+7,有强氧化性。高锰酸钾是最重要的高锰酸盐,为紫红色的针状晶体。 酸性溶液中,高锰酸根离子被还原为无色的Mn2+离子: 碱性溶液中还原,既可得到棕色的MnO2(锰氧化态为+4),也可得到深绿色的MnO42−(锰氧化态为+6)。.
诺贝尔化学奖
诺贝尔化学奖(Nobelpriset i kemi)是诺贝尔奖的奖项之一,由瑞典皇家科学院從1901年开始负责颁发。每年于12月10日,即阿尔弗雷德·诺贝尔逝世周年纪念日颁发。 根據诺贝尔的遺囑,化学奖是为了表彰「在化學領域作出最重要發現或發明的人」。.
新!!: 配合物和诺贝尔化学奖 · 查看更多 »
齿合度
齒合度(denticity)是一個配位化學的名詞,是指在錯合物中,單一配體和中心原子產生鍵結的原子個數。 通常配體只有一個原子和中心原子鍵結,因此齒合度為1,這種的配體也稱為單齒配體。雙齒配體(如草酸根、乙二胺)有二個原子和中心原子鍵結,齒合度為2。EDTA由六個不同的原子和中心原子鍵結,因此EDTA為六齒配體,齒合度為6。 齒合度的英文名稱denticity和dentist(牙醫)有相同表示牙齒的字根。齒合度可以想成是配體以一個點或多個點「咬住」中心原子。 齒合度和哈普托數(hapticity)不同,後者是在配體不是單一原子和中心原子鍵結的情形下,配體參與和中心原子鍵結的電子數。.
辅酶
輔酶是有機非蛋白小分子,其用途為在酵素(酶)內載運化學基。許多輔酶是磷化水溶性維他命。但非維他命物質也可能是輔助,如ATP-磷酸基的生化載具。 輔酶被消耗在其幫助的反應上,如NADH輔酶被氧化還原反應轉化至NAD+。但輔酶是會再產生的,且其在細胞內的濃度會維持在一穩定的程度。 輔酶的一特殊子集為輔基。其輔因子(或稱輔助因子)會緊緊黏在酵素上,且不會在反應中被消耗。輔基包含有鉬蝶呤、硫辛胺和生物素。 酶蛋白與輔酶單獨存在時,一般無催化能力,只有二者結合成完整的分子時,才具有活性 ,此完整的酶分子稱為全酶。.
还原剂
在化合價有改變的氧化還原反應中,氧化數由低變高(即失去电子)的物質稱作還原劑,可稱抗氧化劑,具有還原性,被氧化,其產物叫氧化產物。 还原剂是相对的概念,因为同一物质可能隨反應物質的不同,呈現还原剂或氧化剂的特性。 如:SO2+2HNO3→H2SO4+2H2O+NO2,中SO2是還原劑。 但在2H2S+SO2→3S+H2O中,SO2却是氧化剂。 化合物中如果有处在中间价态的元素,则它们通常是还原剂,如氯化亚锡、硫酸亚铁、一氧化碳、三氯化钛等。 常见的还原剂有:.
过渡金属
过渡元素(Transition element)是指元素周期表中d区的一系列金属元素,又称过渡金属(Transition metal)。一般来说,这一区域包括3到12一共十个族的元素,但不包括f区的内过渡元素。 “过渡元素”这一名词首先由门捷列夫提出,用于代表8、9、10三族元素。他认为从碱金属到锰族是一个“週期”,铜族到卤素又是一个,那么夹在两个周期之间的元素就有过渡的性质。而現今雖然過渡金屬这个词还在使用,但已和原本的意思不同。 过渡金属元素的一个周期称为一个过渡系,第4、5、6周期的元素分别属于第一、二、三过渡系。.
过渡态
-- --是基元反应反应坐标中能量最高的一点所对应的分子构型。处于过渡态的分子也称为活化络合物。理论上,活化络合物是极不稳定的,它向反应物和生成物转化的概率相等;绝对的不可逆反应中,在过渡态这一时刻,所有的碰撞分子都会转化为产物。根据量子力学理论,活化络合物布居为零,过渡态是能量最高的一点,任何扰动都会导致它的改变,故无法分离出来,也是无法观测到的。 过渡态这一概念,对于理解有机反应机理具有很重要的作用。过渡态理论认为,化学反应不是通过反应物分子的简单碰撞就可以完成的,而是在反应物到生成物的过程中,经过了一个高能量的过渡态。这与爬山类似,山的最高点便是过渡态。过渡态是一种不稳定的反应物原子组合体,不可逆反应中,它可以很快地分解为产物。通常反应中间体的能量与过渡态相差不大,两者很难区分。借助于飞秒红外光谱,目前已经可以观测到接近过渡态时的分子构型结构。 Hammond假设认为,反应过渡态的结构与反应的吸放热性质有关,吸热反应中过渡态结构与产物更相似,放热反应则相反。过渡态与中间体能量相差不大时,两者的构型差别很小。 以下是氢氧根离子与溴乙烷发生双分子亲核取代反应中的过渡态示意图。.
胺
胺(英語:amine)是氨分子(NH3)中的氢被烃基取代后形成的一类有机化合物。氨基(-NH2、-NHR、-NR2)是胺的官能团。 如果氮原子连着羰基(C.
阿尔弗雷德·维尔纳
阿尔弗雷德·维尔纳(德语:Alfred Werner,),是一位瑞士化学家。曾經是蘇黎世聯邦理工學院的學生,也是蘇黎世大學的教授。1913年,以提出過渡金屬複合物的八面體幾何結構而获得了诺贝尔化学奖。他打下了現代配位化合物的基礎,他同時也是第一個獲得诺贝尔化学奖的無機化學家。.
新!!: 配合物和阿尔弗雷德·维尔纳 · 查看更多 »
钴
钴是一种化学元素,符号为Co,原子序数27,属过渡金属,铁系元素之一,具有磁性。鈷礦主要為砷化物、氧化物和硫化物。此外,放射性的鈷-60同位素可進行癌症治療。.
铁
铁是一种化学元素,它的化学符号是Fe,它的原子序数是26,它的相对原子质量是56。它是过渡金属的一种。铁是最常用的金属,是地球外核及內核的主要成份,是地殼上豐度第四高的元素和第二高的金屬。鐵常出現在类地行星中,因為鐵是高質量恆星核融合後的產物,鎳-56是放熱核融合反應的最後一個產物,之後會衰變成最常見的鐵同位素。 铁和其他8族元素相同,其氧化態範圍很廣,由−2到+6,但其中+2和+3是最常見的氧化態。在流星体及低氧的環境下,鐵會以单质的形式存在,但是鐵很容易和氧氣和水反應。鐵的表面是有光澤的銀灰色,但在空氣中鐵會反應生成水合的氧化鐵,一般稱為铁锈。許多金屬在氧化後會形成钝化的氧化層,保護內部的金屬不被氧化,但氧化鐵的密度較鐵要低,因此氧化鐵會剝落,無法保護內部的鐵不受腐蝕。.
铬
-- 铬(Chromium,化學符號:Cr)是一種化學元素,其原子序數為24,在VI B族元素中排行首位。其单质是一種銀色的金屬,質地堅硬,表面帶光澤,具有很高的熔點。它無臭、無味,同時具延展性。1797年法国药剂师和化学家路易-尼古拉·沃克兰首度自鉻鉛礦(4)中分離出鉻,被確認是一種化學元素。.
银镜反应
银镜反应(英語:silver mirror reaction)是一價银化合物的溶液被还原为金属银的化学反应,由于生成的金属银附着在容器内壁上,光亮如镜,故称为银镜反应。常见的银镜反应是银氨络合物〈氨銀錯合物〉(又称多倫试剂)被醛类化合物还原为银,而醛被氧化为相应的羧酸根离子的反应,不过除此之外,某些一價银化合物(如硝酸银)亦可被还原剂(如肼)还原,产生银镜。 银镜反应通常是中学化学实验之一。实验室中用这个反应来鉴定含有醛基的化合物,工业上则用这个反应来对玻璃涂银制镜和制保温瓶胆。.
银氨溶液
银氨溶液(Tollens' reagent),也称多伦试剂、吐伦试剂、土伦试剂,指含有二氨合银(I)离子(+)的水溶液,一般由硝酸银或其他银化合物与氨水反应制取,用作银镜反应的试剂。.
铜
铜(copper)是化学元素,化学符号Cu(来自cuprum),原子序数29。纯铜是柔软的金属,表面刚切开时为红橙色帶金屬光澤、延展性好、导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,以及組成众多種合金。铜合金机械性能优异,电阻率很低,其中最重要的是青铜和黄铜。此外,铜也是耐用的金属,可以多次回收而无损其机械性能。 人类使用铜及其合金已有数千年历史。古罗马时期铜的主要开采地是塞浦路斯,因此最初得名cyprium(意为塞浦路斯的金属),后来变为cuprum,这是copper、cuivre和Kupfer的来源。二价铜盐是常见的铜化合物,常呈蓝色或绿色,是蓝铜矿和绿松石等矿物颜色的来源,历史上曾广泛用作颜料。铜质建筑结构受腐蚀后会产生铜绿(碱式碳酸铜)。装饰艺术主要使用金属铜和含铜的颜料。 铜是所有生物所必需的微量膳食矿物质,因为它是呼吸酶复合体细胞色素c氧化酶的关键组分。软体动物和甲壳亚门动物的血液色素血蓝蛋白中含有铜。鱼类和其他哺乳动物的血液中则是含铁的复合物血红蛋白。铜在人体中主要分布于肝脏、肌肉和骨骼中。铜的化合物可用作、杀真菌剂和木材防腐剂。.
铂
鉑(Platinum),化學元素,俗稱白金,化學符號為Pt,原子序為78。鉑密度高、延展性高、反應性低的灰白色貴金屬,屬於過渡金屬。 鉑同屬於鉑系元素和10族元素。它共有六種自然產生的同位素。鉑是地球地殼中罕見的元素,丰度排在第71名,平均豐度大約為5 μg/kg,地壳百万分之0.001为铂。它一般出現在某些鎳和銅礦石中,位於原生元素礦藏,主要分佈在南非,當地的鉑產量佔全球的80%。鉑年產量只有幾百噸,應用亦十分重要,因此非常貴重,是主要的貴金屬貿易商品。 鉑是非常不活泼的金屬。即便在高溫下,它也有極強的抗腐蝕性,屬於抗腐蝕金屬。在自然中,鉑有時以純金屬狀態出現,不與其他元素結合。鉑自然出現在河流的沖積層中,所以前哥倫布時期的南美原住民最早用鉑制作工藝品。歐洲最早在16世紀就有記載使用鉑;1748年,安東尼奧·烏略亞發表報告,描述此來自哥倫比亞的新金屬,這時科學家才開始研究鉑元素。 鉑的應用包括:催化轉換器、實驗室器材、電觸頭和電極、電阻溫度計、牙科器材及首飾等。由於鉑是重金屬,所以它的鹽會危害健康;但鉑的抗腐蝕性強,所以其毒性比一些其他金屬較低。一些含鉑化合物,特別是順鉑,可用於化學療法以治療某些癌症。.
铅
铅(Plumbum,化学符号:Pb)為化学元素,原子序数82。铅是柔軟和展性強延性不佳的弱金属,有毒,也是重金属。铅原本的顏色為青白色,在空气中表面很快被一层暗灰色的氧化物覆盖。可用於建筑、铅酸充电池、弹頭、炮弹、銲接物料、釣魚用具、漁業用具、防輻射物料、奖杯和部份合金,例如電子焊接用的鉛錫合金。.
蔡斯盐
蔡斯鹽(或稱作蔡氏鹽、Zeise鹽)為一黃色、在空氣中穩定的配合物,其化學式為K。蔡斯鹽的陰離子中包含一個η2 的乙烯配體(哈普托數為2,表示乙烯有二個原子參與配位),是以鉑原子為中心的平面正方形結構。此配合物一般是用K2和乙烯製備,催化劑為氯化亞錫。一般販售的蔡斯鹽均為其水合物。 在蔡斯鹽中,乙烯配體是利用π鍵的2個電子參與鍵結,是反饋π鍵典型的例子。.
键合异构
键合异构是配位化合物结构异构的一种形式,配体通过不同的配位原子与中心原子配位。生成的配合物称为键合异构体,配体称为两可配体。.
锌
锌(zinc)是一种化学元素,它的化学符号是Zn,它的原子序数是30,相对原子质量是65.39,是一种浅灰色的过渡金属;鋅由於形、色類似鉛,故也稱為亞鉛,古稱倭鉛。 外觀呈現銀白色,主要用途為鍍鋅,在現代工業中對於電池製造上有不可磨滅的地位,最具代表性之用途為「鍍鋅鐵板」,該技術被廣泛用於汽車、電力、電子及建築等各種產業中,於生活中相當重要的金屬。.
锕系元素
锕系元素以第Ⅲ族副族元素锕为首的一系列元素,是原子序数第89元素锕到第103元素铹,共15种放射性元素,在周期表中占有一个特殊位置。 锕系元素的名稱是因為3族元素锕,有時也會符號An表示锕系元素。锕系元素絕大部份是f區元素,最高能量的電子是在5f電子層,锕系元素只有鐒是d區元素。鑭系元素中大部份也一様是f區元素,不過相較起來,锕系元素的化合價有較多的變化。 锕系元素原子基態的電子構型是5f0~146d0~17s2,这些元素的核外电子分为7层,最外层都是2个电子,次外层多数为8个电子(个别为9或10个电子),从镤到锘电子填入第5层,使第5层电子数从18个增加到32个。 1789年德国馬丁·克拉普羅特从沥青铀矿中发现了铀,它是被人们认识的第一个锕系元素。其后陆续发现了锕、钍和镤。铀以后的元素都是在1940年后用人工核反应合成的,稱為人工合成元素。.
膦
膦(--)是一個官能團,其有機化合物是指磷化氢分子中的氢原子部分或全部被烃基取代的一切衍生物。膦有时也专指磷化氢。.
金
金(gold)是化学元素,化学符号Au(来自aurum),原子序数79。纯金是有明亮光泽、黄中带红、柔软、密度高、有延展性的金属。金在元素周期表中在11族,属过渡金属,是化学性质最不活泼的几种元素之一。金在标准状况下是固体,在自然界中常以游离态单质形式(自然金)存在,如岩石、地下及沖積層中堆积的砂金或金粒。金能和游离态的银形成固溶体琥珀金,在自然界中也能和铜、钯形成合金。矿物中的金化合物不太常见,主要是碲化金。 金的原子序数在宇宙中天然存在的元素中是较高的。据信这种重元素是在两颗中子星碰撞时的超新星核合成中产生,在太阳系形成前的尘埃中就已存在。由于地球形成之初还处于熔化状态,的金几乎都已沉入地核。因此,现在地球上地壳和地幔的金多是拜后来后期重轰炸期(约40亿年前)的小行星撞击事件所赐。 金能抵抗单一酸的侵蚀,但却能被王水溶解(“王水”因此得名)。这种混合酸能和金反应生成四氯合金酸根离子。金也能溶于碱性氰化物溶液,这是其开采和电镀的原理。能夠溶解銀及卑金屬的硝酸不能溶解金,这些性質是黃金精煉技術的基础,也是用硝酸来鉴别物品裡是否含有金的原理,这一方法是英語諺語「acid test」的語源,意指用「測試黃金的標準」来測試目標物是否名副其實。此外,金能溶于水銀,形成汞齊(也是一种合金),但这并非化学反應。 金在有历史记载以前就是一種廣受歡迎的貴金屬,用于貨幣、保值物、珠寶和艺术品。以前国内和国际通常实行以金为基础的金本位货币制度,但1930年代时金币已停止流通。70年代,随着布雷頓森林協定的结束,世界范围内的金本位制终于让位给法定货币制度。不过因其稀有,易于熔炼、加工和铸币,色泽独特,抗腐蚀,不易和其他物质反应等特点,金的价值不减。 底,人类总共开采18.36万公噸(相当于9513立方米)的金。 产量中的50%用于珠宝,40%用于投资,还有10%用于工业。 因其高延展性,抗腐蚀性,在大多数反应中的惰性和导电性,金一直在各类电子设备中用作耐腐蚀的电子连接器,这是它的主要工业用途。此外它还用于屏蔽红外线,生产和金箔,以及修补牙齿。有些金盐在医学上仍作为消炎药使用。.
金屬羰基配合物
金屬羰基配合物是過渡金屬和一氧化碳配基(即羰基,羰的拼音為tāng)形成的配合物。配合物可以是均配物,也就是所有的配基都相同(都是一氧化碳),如四羰基鎳(Ni(CO)4),不過大部份的金屬羰基配合物中,會出現其他的配基,如Re(CO)3(bipy)Cl。在許多有機化合物的合成反應中(如氫甲醯化反應),一氧化碳是重要的原料之一,而金屬羰基配合物常常作為這些反應中的催化劑。 金屬羰基配合物為有毒的化合物,因為這類配合物會和血红蛋白反應形成碳氧血红蛋白,使血红蛋白無法輸送氧氣Elschenbroich, C."Organometallics" (2006) Wiley-VCH: Weinheim.
新!!: 配合物和金屬羰基配合物 · 查看更多 »
镁
镁(Magnesium)是一种化学元素,它的化学符号是Mg,它的原子序数是12,是一種银白色的碱土金属。鎂是在地球的地殼中第八豐富的元素,約佔2%的質量,亦是宇宙中第九多元素。.
镍
是一種化學元素,化學符號為Ni,原子序數為28。它是一種有光澤的銀白色金屬,其銀白色帶一點淡金色。鎳屬於過渡金屬,質硬,具延展性。純鎳的化學活性相當高,這種活性可以在反應表面積最大化的粉末狀態下看到,但大塊的鎳金屬與周圍的空氣反應緩慢,因為其表面已形成了一層帶保護性質的氧化物。即使如此,由於鎳與氧之間的活性夠高,所以在地球表面還是很難找到自然的金屬鎳。地球表面的自然鎳都被封在較大的鎳鐵隕石裏面,這是因為隕石在太空的時候接觸不到氧氣的緣故。在地球上,這種自然鎳總會和鐵結合在一起,這點反映出它們都是超新星核合成主要的最終產物。一般認為地球的地核就是由鎳鐵混合物所組成的。 鎳的使用(天然的隕鎳鐵合金)最早可追溯至公元前3500年。阿克塞尔·弗雷德里克·克龙斯泰特於1751年最早分離出鎳,並將它界定為化學元素,儘管他最初把鎳礦石誤認為銅的礦物。鎳的外語名字來自德國礦工傳說中同名的淘氣妖精(Nickel,與英語中魔鬼別稱"Old Nick"相近),這是由於鎳銅礦不能用煉銅的方法煉出銅來,所以被比擬成妖魔。鎳最經濟的主要來源為鐵礦石褐鐵礦,含鎳量一般為1-2%。鎳的其他重要礦物包括硅鎂鎳礦及鎳黃鐵礦。鎳的主要生產地包括加拿大的索德柏立區(一般認為該處是隕石撞擊坑)、太平洋的新喀里多尼亞及俄羅斯的諾里爾斯克。 由於鎳在室溫時的氧化緩慢,所以一般視為具有耐腐蝕性。歷史上,因為這一點鎳被用作電鍍各種表面,例如金屬(如鐵及黃銅)、化學裝置內部及某些需要保持閃亮銀光的合金(例如鎳銀)。世界鎳生產量中的約6%仍被用於抗腐蝕純鎳電鍍。鎳曾經是硬幣的常見成份,但現時這方面已大致上被較便宜的鐵所取代,尤其是因為有些人的皮膚對鎳過敏。儘管如此,英國還是在皮膚科醫生的反對下,於2012年開始再使用鎳鑄造錢幣。 只有四種元素在室溫時具有鐵磁性,鎳就是其中一種。含鎳的鋁鎳鈷合金永久磁鐵,其磁力強度介乎於含鐵的永久磁鐵與稀土磁鐵之間。鎳在現代世界的的地位主要來自於它的各種合金。全世界鎳產量中的約60%被用於生產各種鎳鋼(特別是不鏽鋼)。其他常見的合金,還有一些的新的高溫合金,就幾乎就佔盡了餘下的世界鎳用量。用於製作化合物的化學用途只佔了鎳產量的不到3%。作為化合物,鎳在化學製造有好幾種特定的用途,例如作為氫化反應的催化劑。某些微生物和植物的酶用鎳作為活性位點,因此鎳是它們重要的養分。.
镧系元素
镧系元素是第57号元素镧到71号元素镥15种元素的统称。镧系元素的外层和次外层的电子构型基本相同,电子逐一填充到4f轨道上。镧系元素也属于过渡元素,只是镧系元素新增加的电子大都填入了从外侧数第三个电子层(即4f电子层)中,所以镧系元素又可以称为4f系。为了区别于元素周期表中的d区过渡元素,故又将镧系元素(及锕系元素)称为内过渡元素。由于镧系元素都是金属,所以又可以和锕系元素统称为f区金属。镧系元素用符号Ln表示。 所有镧系元素既能生成化学性质类似的三价化合物,个别镧系元素也能生成比较稳定或不很稳定的四价或二价化合物,所以15个元素的化学性质并不完全相似,在光学、电磁学等物理性质也有较大的差别。 镧系元素原子基态的电子构型是4f0~145d0~16s2。.
镜子
#重定向 鏡.
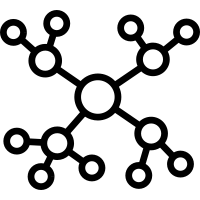
配合物
配位化合物(coordination complex),--,包含由中心原子或离子与几个配体分子或离子以配位键相结合而形成的复杂分子或离子,通常称为「配位单元」。凡是含有配位单元的化合物都称做配位化合物。研究配合物的化学分支称为配位化学。 配合物是化合物中较大的一个子类别,广泛应用于日常生活、工业生产及生命科学中,近些年来的发展尤其迅速。它不仅与无机化合物、有机金属化合物相關聯,并且与现今化学前沿的原子簇化学、配位催化及分子生物学都有很大的重叠。.
配位异构
配位异构是构型异构的一种形式。在配位异构中,组成的复合离子具有不同的构型,这些离子成为配位异构物。.
配位场理论
配位场理论(Ligand field theory,首字母缩略字:LFT)是晶体场理论和分子轨道理论的结合,用以解释配位化合物中的成键情况。 与晶体场理论不同的是,配位场理论考虑配体与中心原子之间一定程度的共价键合,可以解释晶体场理论无法解释的光谱化学序列等现象。一般LFT选取的模型都为八面体构型,即六个配体沿坐标轴正负指向中心原子,以方便理解。.
配位键
配位鍵(Coordinate Covalent Bond,又稱配位共價鍵,或簡稱配鍵),是一種特殊的共價鍵。當共價鍵中共用的電子對是由其中一原子獨自供應時,就稱配位鍵。配位鍵形成後,與一般共價鍵無異。.
配位数
配位化学中,配位数指化合物中中心原子周围的配位原子个数,此概念首先由阿尔弗雷德·维尔纳在1893年提出。 配位数通常为2-8,也有高达10以上的,如铀和钍的双齿簇状硝酸根离子U(NO3)62−、Th(NO3)62−,及2007年研究的PbHe152+离子(铅的配位数至少为15),2015年研究的CoB16−(配位数为16)。 此概念也可延伸至任何化合物,也就是配位数等同于共价键键连数,例如,可以说甲烷中碳的配位数为4。这种说法通常不计π键。 晶体学中,配位数是晶格中与某一原子相距最近的原子个数。配位数与晶体结构或晶胞类型有关,且决定原子堆积的紧密程度,體心立方堆積中原子配位数为8。最高的配位数为12,存在于六方紧密堆积和立方紧密堆积结构中。.
配體
配體(ligand,也稱為配基、配位基)是一個化學名詞,表示可和中心原子(金屬或類金屬)產生鍵結的原子、分子和離子。一般而言,配體在參與鍵結時至少會提供一個電子。配體扮演路易士鹼的角色。但在少数情况中配体接受电子,充当路易斯酸。 在有機化學中,配体常用來保護其他的官能团(例如配体BH3可保護PH3)或是穩定一些容易反應的化合物(如四氢呋喃作為BH3的配体)。中心原子和配基組合而成的化合物稱為配合物。 金屬及類金屬只有在高度真空的環境,可以以氣態、不受和其他原子鍵結的條件存在。除此以外,金屬和類金屬都會和其他原子以配位或共價鍵的方式鍵結。络合物中的配體主宰了中心金屬的的活性,其受配體本身被替換的速度、配體的活性等因素影響。在生物無機化學、藥物化學、均相催化及環境化學等領域中,如何選擇配體都是個重要的課題。 一般配体可依其帶電、大小、其原子特性及可提供電子數(如齿合度或哈普托數)加以分類。而配體的大小可以用其圆锥角來表示。 -->.
酶
酶(Enzyme( ))是一类大分子生物催化劑。酶能加快化學反應的速度(即具有催化作用)。由酶催化的反應中,反應物稱爲底物,生成的物質稱爲產物。幾乎所有細胞內的代謝過程都離不開酶。酶能大大加快這些過程中各化學反應進行的速率,使代謝產生的物質和能量能滿足生物體的需求。細胞中酶的類型對可在該細胞中發生的代謝途徑的類型起決定作用。對酶進行研究的學科稱爲「酶學」(enzymology)。 目前已知酶可以催化超過5000種生化反應。大部分酶是蛋白質,有少部分酶是具有催化活性的RNA分子,这些酶被称为核酶。酶的特異性是由其獨特的三級結構決定的。 和所有的催化劑一樣,酶通過降低反應活化能加快化學反應的速率。一些酶可以將底物轉化爲產物的速率提高數百萬倍。一個比較極端的例子是。該酶可以使在無催化劑條件下需要進行數百萬年的化學反應在幾毫秒內完成。從化學原理上講,酶和其它所有催化劑一樣,反應不會使其物質量發生變化。酶亦不能改變化學平衡,這一點和其它催化劑也是一樣的。酶和其它催化劑的不同之處在於,它們的專一性要強得多。一些分子可以影響酶的活性。如酶抑制劑能降低酶的活性,酶激活劑能提高酶的活性。許多藥物及毒物是酶的抑制劑。當超出適宜的溫度和pH值後,酶的活性會顯著下降。 酶在工业和人们的日常生活中的应用也非常广泛。例如,药厂用特定的合成酶来合成抗生素;洗衣粉中添加酶能加速附着在衣物上的蛋白质、淀粉或脂肪漬的分解;嫩肉粉中加入木瓜蛋白酶能將蛋白質分解爲稍小的分子,使肉的口感更嫩滑。.
酸碱理论
酸碱理论指阐述酸、碱及酸碱反应本质的各种理论。在历史上曾有多种酸碱理论,其中重要的包括:.
酸碱电子理论
酸碱电子理论,也称广义酸碱理论、路易斯酸碱理论,是1923年美国化学家吉尔伯特·路易斯提出的一种酸碱理论。该理论认为:凡是可以接受外来电子对的分子、基团或离子为酸(路易斯酸);凡可以提供电子对的分子、基团或离子为碱(路易斯碱)。因為跳脫了限定氫離子與氫氧根的酸鹼概念,这种理论包含的酸碱范围很广,但是,它对确定酸碱的相对强弱来说,没有统一的标度,对酸碱的反应方向难以判断。后来,提出的软硬酸碱理论弥补了这种理论的缺陷。 常見的路易斯酸有:.
新!!: 配合物和酸碱电子理论 · 查看更多 »
苯
4.92MPa |- | bgcolor.
雙三角錐
在幾何學中,雙三角錐是一種基底為三角形的雙錐體,其為三角柱的對偶。若每個面皆為正三角形,則為92種Johnson多面體(J12)中的其中一個,也是雙角錐的其中一種。顧名思義,它可由正多面體中的兩個大小相同的正四面體組合而成。這92種詹森多面體最早在1996年由(Norman Johnson)命名並給予描述。 若不考慮每個面皆為正三角形,只考慮基底為正三角形時,則有可能為廣義的半正多面體的對偶,正三角柱的對偶,此時能使用施萊夫例符號表示,計為 + ,而在考克斯特符號中,則可以用或表示。.
Hexol
Hexol分子式为(SO4)3,是阿尔弗雷德·维尔纳在1914年以硫酸钴(Ⅱ)为起始原料合成的一种无机有旋光异构性的配合物。它从结构上来讲是一个以羟桥相连的四核钴配合物,也是第一个制得的纯粹不含碳的手性分子,摩尔旋光为−47610°,这是一般有光学活性的有机化合物所无法比拟的。 在制得该配合物后,维尔纳又成功地拆分出左旋体和右旋体。该拆分过程中,维尔纳先用hexol的氯化物盐与手性拆分剂D-(+)-溴代樟脑磺酸银盐反应,沉淀出D-hexol与之生成的盐,然后过滤,并对滤渣和滤液分别进行处理,便可得到D-hexol和L-hexol。hexol的制备和拆分的成功有力证明了维尔纳配位理论的真实和正确性,从而奠定了配位化学的基础。 此外,维尔纳从制备Fremy盐的副产物中,又得到了第二种hexol。该hexol分子不含有手性,维尔纳错误地认为它是一个具有直线型的三核钴结构的配合物: 2004年,对上述hexol的重新分析发现它实际上是一个六核的配合物:.
橋接配體
橋接配體(或称桥联配体、桥连配体)是連接二個或二個以上原子(通常是金屬原子)的配體。配體本身可以是單原子,也可以由多個原子組成。由於所有複雜的有機化合物都可以擔任橋接配體的角色,因此「橋接配體」一詞一般是指較小的配基(如鹵素和擬鹵素)或是特別用來連結二個金屬原子的配基。 在命名有橋接配體的錯合物時,橋接配體前會標示一個帶有上標數字的μ,上標數字表示橋接配體所連接的原子個數。而μ2常會簡稱μ。.
檸檬酸鈉
柠檬酸钠(sodium citrate),又稱枸橼酸钠,是一種有機酸鈉鹽。外觀為白色到無色晶體,有肥皂水的味道。K.
比色法
#重定向 色度学.
氟化物
氟化物指含负价氟的有机或無機化合物。与其他卤素类似,氟生成单负阴离子(氟离子F−)。氟可与除He、Ne和Ar外的所有元素形成二元化合物。从致命毒素沙林到药品依法韦仑,从难溶的氟化钙到反应性很强的四氟化硫和三氟化氯都属于氟化物的范畴。.
氢
氫是一種化學元素,其化學符號為H,原子序為1。氫的原子量為,是元素週期表中最輕的元素。單原子氫(H)是宇宙中最常見的化學物質,佔重子總質量的75%。等離子態的氫是主序星的主要成份。氫的最常見同位素是「氕」(此名稱甚少使用,符號為1H),含1個質子,不含中子;天然氫還含極少量的同位素「氘」(2H),含1個質子和1個中子。 氫原子最早在宇宙復合階段出現並遍佈全宇宙。在標準溫度和壓力之下,氫形成雙原子分子(分子式為H2),呈無色、無臭、無味非金屬氣體,不具毒性,高度易燃。氫很容易和大部份非金屬元素形成共價鍵,所以地球上大部份的氫都以分子的形態存在,比如水和有機化合物等。氫在酸鹼反應中尤其重要,因為在這類反應中各種分子須互相交換質子。在離子化合物中,氫原子可以獲得一個電子成為氫陰離子(H−),或失去一個電子成為氫陽離子(H+)。雖然在一般寫法中,氫陽離子就是質子,但在實際化合物中,氫陽離子的實際結構是更為複雜的。氫原子是唯一一個有薛定諤方程式解析解的原子,所以對氫原子模型的研究在量子力學的發展過程中起到了關鍵的作用。 16世紀,人們通過混合金屬和強酸,首次製備出氫氣。1766至1781年,亨利·卡文迪什第一次發現氫氣是一種獨立的物質,燃燒後會產生水。安東萬-羅倫·德·拉瓦節根據這一性質,將其命名為「Hydrogen」,在希臘文中意為「生成水的物質」。19世纪50年代,英国医生合信编写《博物新编》(1855年)时,把元素名翻译为“轻气”,成為今天中文「氫」字的來源。 氫氣的工業生產主要使用天然氣的蒸汽重整過程,或通過能源消耗更高的水電解反應。大部份的氫氣都在生產地點直接使用,主要應用包括化石燃料處理(如裂化反應)和氨生產(一般用於化肥工業)。在冶金學上,氫氣會對許多金屬造成氫脆現象,使運輸管和儲存罐的設計更加複雜。.
氢化物
氢化物是一类氢的化合物。严格意义上讲,氢化物只包含氢同金属相互结合的化合物,但由于概念的扩大,有时它也包含水、氨和碳氢化合物等物质。.
氢负离子
氢负离子(H−)是氢原子获得一个电子后产生的单价负离子,它是恒星(如太阳)大气的重要组分,作为能量0.75-4.0 eV的光子的主要吸收剂,也存在于地球电离层中。 氢负离子是很强的还原剂,它与氢气形成的半反应的标准电极电势为−2.25 V。它是除电子盐中的电子外最简单的负离子,含两个电子、一个质子。 形式上含氢负离子的化合物称为氢化物。 氢负离子 H−,由两个电子及一个质子组成,是已知除电子盐(Electride)外最小的阴离子。氢负离子不能在水溶液中存在,是已知的最强碱之一,这可通过以下生成反应看出: 负氢是非常强的还原剂: 已知自由氢负离子的有效半径为208pm。这个数据与其他数据比较时,特别是与He原子的93pm,H原子的50pm,Cl−的结晶半径181pm,H的共价半径30pm,及类盐氢化物中H−的半径(134-154pm)相比是有趣的。这个反常大的半径可以用H−的核电荷较小,电子彼此排斥和对核引力的屏蔽效应来解释。F.
氢氧根
氫氧離子,化學符號為OH-。其中氢和氧之间以共价键连接,整体带一单位的负电荷。常常與不同的元素組成氫氧化物。.
氧化剂
氧化剂是一类具有氧化性的物质。在化合价有改变的氧化还原反应中,由高价变到低价(即搶到电子)的物质作氧化剂,具有氧化性,可以被还原,其产物叫还原产物。 另一方面,氧化剂也是一类危险化学品的总称,它属于中华人民共和国《危险化学品名录》的第5类危险化学品。.
氧化还原反应
氧化还原反应(Reduction-oxidation reaction,簡稱Redox)是在反应前后元素的氧化数具有相应的升降变化的化学反应。这种反应可以理解成由两个半反应构成,即氧化反应和还原反应。此类反应都遵守电荷守恒。在氧化還原反應裡,氧化與還原必然以等量同時進行。 一般来说,同一反应中还原产物的还原性比还原剂弱,氧化产物的氧化性比氧化剂弱,这就是所谓“强还原剂制弱还原剂,强氧化剂制弱氧化剂”。換言之:.
新!!: 配合物和氧化还原反应 · 查看更多 »
氧化数
氧化数(英文:Oxidation number)用来表示配位化合物中,所有配体及成配位键的电子对都被去掉后,中心原子所带的电荷数。氧化数这个概念被用于无机化学命名法中。标明氧化数使用罗马数字,并且省略正氧化数的正号。书写时既可以将氧化数写成上标标在元素符号后面,如 FeIII,也可将氧化数写在括号内标在元素名称后面,如铁(III),元素名称与括号之间不留空格。 氧化数通常在数值上等于氧化态。但在有些情况下,配体不如中心原子电负性强(如铱膦配合物),因此氧化数与氧化态不相等。.
氧化态
氧化态(英文:Oxidation State)表示一个化合物中某个原子的氧化程度。形式氧化态是通过假设所有异核化学键都为100%离子键而算出来的。氧化态用阿拉伯数字表示,可以为正数、负数或是零。 氧化态的升高称为氧化,降低则称为还原。这两个过程涉及电子的形式转移,即总体上看,还原是获得电子的过程,而氧化是失去电子的过程。 IUPAC对氧化态的定义为: “氧化态:一种化学物质中某个原子氧化程度的量度。根据以下公认的规则可计算该原子的电荷:.
氧气
氧气(Oxygen, Dioxygen,分子式O2)是氧元素最常见的单质形态,在空气中按体积分数算大约占21%,在标准状况下是气体,不易溶于水,密度比空气略大,氧气的密度是1.429g/L 。不可燃,可助燃。.
氨
氨(Ammonia,或称氨氣、阿摩尼亞或無水氨,分子式为NH3)是无色气体,有强烈的刺激气味,极易溶于水。常温常压下,1單位体积水可溶解700倍体积的氨。氨對地球上的生物相當重要,是所有食物和肥料的重要成分。氨也是很多藥物和商業清潔用品直接或间接的組成部分,具有腐蝕性等危險性质。 由於氨有廣泛的用途,成為世界上產量最多的無機化合物之一,約八成用於製作化肥。2006年,氨的全球產量估計為1.465億吨,主要用於製造商業清潔產品。 氨可以提供孤電子對,所以也是路易斯鹼。.
氨基酸
胺基酸是生物學上重要的有機化合物,它是由胺基(-NH2)和羧基(-COOH)的官能團組成的,以及一個側鏈连到每一個胺基酸。胺基酸是構成蛋白質的基本單位。賦予蛋白質特定的分子結構形態,使他的分子具有生化活性。蛋白質是生物体內重要的活性分子,包括催化新陳代謝的酶(又称“酵素”)。 不同的胺基酸脱水缩合形成肽(蛋白質的原始片段),是蛋白質生成的前.
氨络物
在配位化学中,氨的配合物被称为氨络物。 英文拼写上,氨络物(Ammine)双写了字母“m”以区别于有机物中的胺类物质(Amine)。 在化工方面,一些试剂中会含有氨络物离子。如,三价钴离子的盐中实际上常含有六氨合钴(hexaamminecobalt(III) (如三氯化六氨合钴,hexaamminecobalt(III) chloride,Cl3)。.
氨水
氨水(NH3 或者 NH4OH)常称为阿摩尼亚水,指氨气的水溶液,有强烈刺鼻气味,具弱碱性。 氨水中,氨气分子发生微弱水解生成氢氧根离子及铵根离子。“氢氧化铵”事实上并不存在,只是对氨水溶液中的离子的描述,并无法从溶液中分离出来。 氨的在水中的电离可以表示为: 反應平衡常數Kb.
氮
氮是一种化学元素,其化学符号为N;原子序数是7。在自然界中氮单质最普遍的形态是氮气,这是一种在标准状况下无色无味无臭的雙原子气体分子,由于化学性质稳定而不容易发生化學反应。氮气是地球大气中含量最多的气体,佔總體積的78.09%。1772年在苏格兰爱丁堡,由丹尼尔·卢瑟福分離空氣後发现。氮属于氮族元素中的一种。 氮是宇宙中常見的元素,在銀河系及太陽系的豐度排第七名。其生成的原因推測是由於超新星中碳和氫產生的核融合。由於氮元素及其和氫、氧形成的常见化合物都极易揮發,因此在內太陽系中的類地行星中氮元素較不常見。不過和地球一样,其他行星及其卫星的大氣層中,气态的氮及其化合物很常见。 很多工业上很重要的化合物(比如氨、硝酸、用作推进剂或炸药的有机硝酸盐以及氰化物)都含有氮原子。氮原子之间具有非常牢固的化学键,无论是在工业中或是在生物体內,将转化为有用的含氮化合物都是很不容易的。相应的,当含氮化合物燃烧,爆炸或分解时会产生氮气,并通常可以释放大量有用的能量。合成产生的氨和硝酸盐是关键的工业化肥料,而硝酸盐肥料是引起水系统富营养化的关键污染物。 含氮化合物除了作为肥料和能量储存的功用之外还有其他多种用途。氮是克維拉纤维和氰基丙烯酸酯强力胶水等多种材料的组成部分。在各种药学药品的大类中(包括抗生素)都含有氮元素。许多药物都是天然含氮信号分子的类似物或前体药物。比如,有机硝酸盐硝酸甘油和硝普钠在体内代谢产生一氧化氮以控制血压。植物中的生物鹼(经常是防卫性化合物)根据定义是含有氮的,许多知名的含氮药物(比如咖啡因和吗啡)是生物碱或是合成的天然产物类似物,像许多植物生物碱一样用作于动物体内的神经传导物质的接收器上(例如合成苯丙胺)。 氮主要存在于所有的有机体的氨基酸(以及蛋白质)和核酸(DNA和RNA)之中。人类身体中的3%的重量都是氮元素构成的,其含量仅次于氧元素、碳元素和氢元素。氮循环是指氮元素从空气进入生物圈和有机化合物中然后再返回大气的转移过程。.
氯化亚汞
氯化亚汞(化学式:Hg2Cl2),俗称甘汞,室温下为无味白色至黄色的四方晶系晶体,是汞(I)的氯化物。少量的甘汞无毒,常用于制取饱和甘汞电极,是电化学中常用的参比电极, 也可在医药上用于泻剂、防腐剂、利尿剂等。25°C时,它在水中的标准电极电势Eo为0.2682V:.
氯化物
氯化物在无机化学领域里是指带负电的氯离子和其它元素带正电的阳离子结合而形成的盐类化合物。最常见的氯化物比如氯化钠(俗称食盐)。常见的氯化物列在右表。但有時金屬(如金)溶解在王水時會產生一種叫氯某酸(如氯金酸),一氧化氮和水。.
氯化錫
氯化錫,化學式SnCl,為無色發煙性液體。.
氯化铁
氯化铁(FeCl3)又称三氯化铁,是三价铁的氯化物。它易潮解,在潮湿的空气会水解,溶于水时会释放大量热,并产生啡色的酸性溶液。这个溶液可蚀刻铜制的金属,甚至不锈钢。 无水的氯化铁是很强的路易斯酸,可用作有机合成的催化剂。啡黄色的六水物是氯化铁常见的商业制品,其结构为Cl·2H2O(参见三氯化铬)。 加热至约315℃,氯化铁便熔化,然后变成气态。气体内含有一些Fe2Cl6(参见氯化铝),会渐渐分解成氯化亚铁(FeCl2)和氯气(Cl2)。.
氯化银
氯化銀是銀的氯化物,化学式AgCl。其天然礦物稱為角銀礦,亦可由可溶的銀化合物如硝酸銀與氯離子反應獲得。.
氯化铵
氯化铵(化学式:NH4Cl)无色立方晶体或白色结晶,其味咸凉有微苦。易溶于水和液氨,并微溶于醇;但不溶于丙酮和乙醚。水溶液呈弱酸性,加热时酸性增强。 由于铵离子的配位性,氯化铵溶液对金属有腐蚀性,特别对铜腐蚀更大。.
氯化汞
氯化汞(化学式:HgCl2)俗称升汞,室温下为白色晶体,是实验室常用试剂。可溶于水,加热易升华,可引起汞中毒,因为毒性极大,使用时必须小心。.
氰化物
--是特指带有氰离子(CN−)或氰基(-CN)的化合物,其中的碳原子和氮原子通过參键相连接。这一參键给予氰基以相当高的稳定性,使之在通常的化学反应中都以一个整体存在。因该基团具有和卤素类似的化学性质,常被称为拟卤素。通常为人所了解的氰化物都是无机氰化物,俗稱山奈或山埃(來自英語音譯“Cyanide”),是指包含有氰根离子(CN−)的无机盐,可认为是氢氰酸(HCN)的盐,常见的有氰化钾和氰化钠。它们多有剧毒,故而为世人熟知。另有有机氰化物,是由氰基通过单键与另外的碳原子结合而成。视结合方式的不同,有机氰化物可分类为腈(-CN)和异腈(-NC),相应的,氰基可被称为腈基(-CN)或异腈基(-NC)。.
水分子
#重定向 水的性質.
活化能
活化能(Activation energy)是一个化学名词,又被称为阈能。这一名词是由阿瑞尼士在1889年引入,用来定义一个化学反应的发生所需要克服的能量障碍。活化能可以用于表示一个化学反应发生所需要的最小能量,因此活化能越高,反应越难进行。反应的活化能通常表示为Ea,单位是千焦耳每摩尔(kJ/mol)。 活化能基本上是表示势垒(有时称为能垒)的高度。.
混成軌域
混成軌域(Hybrid orbital)是指原子軌域經混成(hybridization)後所形成的能量简并的新轨道,用以定量描述原子間的鍵結性質。與價層電子對互斥理論可共同用來解釋分子軌域的形狀。混成概念是萊納斯·鮑林於1931年提出。.
溶剂
溶剂是一种可以溶解固体,液体或气体溶质的液体,继而成为溶液。在日常生活中最普遍的溶剂是水。而所谓有机溶剂即是包含碳原子的有机化合物溶剂。溶剂通常拥有比较低的沸点和容易挥发。或是可以由蒸馏来去除,从而留下被溶物。因此,溶剂不可以对溶质产生化学反应。它们必须为低活性的。溶剂可从混合物萃取可溶化合物,最普遍的例子是以热水冲泡咖啡或茶。溶剂通常是透明,无色的液体,他们大多都有独特的气味。 溶液的浓度取决于溶解在溶剂内的物质的多少。溶解度则是溶剂在特定温度下,可以溶解最多多少物质。 有机溶剂主要用于干洗(例如四氯乙烯),作涂料稀释剂(例如甲苯、香蕉水、松香水、松节油),作洗甲水或去除胶水(例如丙酮,醋酸甲酯,醋酸乙酯),除锈(例如己烷),作洗洁精(柠檬精),用于香水(酒精)跟用于化学合成。.
溶解性
溶解性或溶解度()是指定溫、定壓時,每單位飽和溶液中所含溶質的量;也就是一种物质能够被溶解的最大程度或飽和溶液的濃度。通常用體積莫耳濃度、質量百分濃度或「每100公克溶劑能溶解的溶質重」表示之。溶解度主要取决于溶质在溶劑中的溶解平衡常数(溶度積)、溫度、極性、和-zh-hans:压强; zh-hk:壓強; zh-tw:壓力-。相同溶質在不同溶劑下的溶解度不盡相同;相同溶劑在不同溶質下的溶解度不盡相同;即便是相同的溶質和溶液,在不同的環境因素下溶解度也不盡相同。 當溶質分子進入溶液時,因為分子可以自由移動,有些分子會碰撞到未溶解的晶體表面,並被吸引回到晶體表面析出,此即為結晶或沉澱。在分子不斷溶解和結晶的過程中,當溶解速率和結晶速率相等時,稱為溶解平衡。達到溶解平衡的溶液稱為飽和溶液,此時溶質的濃度定義為溶解度。濃度低於溶解度的溶液稱為未飽和溶液;在某些特殊環境下,會產生濃度大於溶解度的溶液,稱為'''過飽和溶液'''。 如果一种溶质對溶液的溶解度很高,我们就说这种物质是可溶的;如果溶解度不高,称这种物质是微溶的;如果溶解度極低,则称这种物质是不溶或难溶的。在台灣,可溶、微溶、難溶這三種狀態分別以體積莫耳濃度10^M和10^M做為分野。在中國大陸,將每100mL溶剂中溶质的溶解度小于0.01g的物质称为难溶物质,在0.01~1克之间的为微溶,1~10克为可溶,10克以上为易溶。.
滴定
滴定(titration),在分析化学中是一种分析溶液成分的方法。将标准溶液逐滴加入被分析溶液中,用颜色变化、沉淀或电导率变化等来确定反应的终点。由于体积测定是滴定的关键,滴定分析又称容量分析。 滴定通过两种溶液的定量反应来确定某种溶质的含量。滴定最基本的公式为: \frac.
指示剂
指示剂是分析化学中的一类试剂,它用于滴定操作中,用来指示滴定反应的终点。滴定反应需要灵敏的指示剂来指示反应的完成。指示剂在反应完成时,会迅速变成另一种颜色。这样实验者就可以根据指示剂的变色来确定反应的终止。.
有机化学
有机化学是研究有机化合物及有機物質的结构、性质、反應的学科,是化学中极重要的一个分支。有机化学研究的對象是以不同形式包含碳原子的物質 ,又称为碳化合物的化学。 有關有机化合物或有機物質結構的研究包括用光譜、核磁共振、红外光谱、紫外光谱、质谱或其他物理或化學方式來確認其組成的元素、組成方式、實驗式及化學式。有關性質的研究包括其物理性質及化學性質,也需評估其,目的是要了解有機物質在其純物質形式(若是可能的話),以及在溶液中或是混合物中的性質。有機反應的研究包括有機物質的製備(可能是有機合成或是其他方式),以及其化學反應,可能是在實驗室中的,或是In silico(經由電腦模擬的)。 有机化学研究的範圍包括碳氫化合物,也就是只由碳和氫組成的化合物,化合物中也有可能还会参与其他的元素,包括氢、 氮、氧和卤素,还有诸如磷、硅、硫等元素。 。有机化学和許多相關領域有重疊,包括药物化学、生物化学、有机金属化学、高分子化学以及材料科学等。 有机化合物之所以引起研究者浓厚的兴趣,是因为碳原子可以形成稳定的长碳链或碳环以及许许多多种的官能基,这种性质造就有机化合物的多样性。有機化合物是所有碳基生物的基礎。有機化合物的應用範圍很廣,包括醫學、塑膠、藥物、、食物、化妆品、护理用品、炸藥及塗料等。.
有机金属化学
有机金属化学是有机化学和無機化學交疊的一門分支課程,研究含有金屬(包括類金屬)和碳原子鍵結的有机金属化合物,其化學反應、合成等各種問題。 其中的化學反應,包含了許多催化性質的反應以及跟金屬配位有關的化學反應,甚至有些是運用在於醫藥上,如用于治疗糖尿病的含釩的配合物。.
新!!: 配合物和有机金属化学 · 查看更多 »
无机化合物
无机化合物即无机物,一般指不含碳元素的化合物,如水、食鹽、硫酸等。但一些簡單的含有碳元素化合物如一氧化碳、二氧化碳、碳酸、碳酸鹽、氰化物和碳化物等,由於它們的組成和性質與其他无机化合物相似,因此也作為无机化合物來研究。絕大多數的无机化合物可以歸入氧化物、酸、鹼、鹽四大類。.
无机化学
无机化学是研究无机化合物的化学分支学科。通常,无机化合物与有机化合物相对,指不含C-H键的化合物,因此一氧化碳、二氧化碳、二硫化碳、氰化物、硫氰酸盐、碳酸及碳酸盐等都属于无机化学研究的范畴。但这二者界限并不严格,之间有较大的重叠,有机金属化学即是一例。.
无机化学命名法
无机化学命名法是命名无机化合物的标准化方法,其遵循IUPAC命名法(Nomenclature of Inorganic Chemistry,2005)和《无机化学命名原则(1980)》(中国化学会)两部现行命名法。对于还未统一中文命名的名称,以IUPAC英文命名标注,后加括号内有建议使用的中文名称。.
新!!: 配合物和无机化学命名法 · 查看更多 »
普鲁士蓝
普魯士藍(Prussian blue;Preußisch Blau 或 Berliner Blau;化學名稱:亞鐵氰化鐵;分子式:Fe7(CN)18⋅14H2O,或書寫成 · x簡稱:PB)是一種深藍色的顏料,在畫圖和青花瓷器中應用。普魯士藍是狄斯巴赫(Johann Jacob Diesbach)在意外中被發現,他原本是打算製造紅色顏料的。滕士蓝(Turnbull's blue)与普鲁士蓝是同一种物质,只是由不同试剂制取的。 德国的前身普鲁士军队的制服颜色就是使用该种颜色,以至1871年德意志第二帝国成立后相当长一段时间仍然沿用普鲁士蓝军服,直至第一次世界大战前夕方更换成。 普鲁士蓝,或柏林蓝,或滕士蓝的扩展含义并非一种颜色,而是指氰化亚铁这种深蓝色染料。氰化亚铁染料本身在历史上已有多次出现,甚至可追溯至古埃及,直至据现有记载1706年由Johann Jacob Diesbach于柏林人工合成,后经现代手段分析,并开发出工业合成手段,由BASF前身IG Farben工业大批量生产。作为首次出现的工业合成染料,因氰化亚铁的稳定性,且不溶于水,其着色效果远强于以往的有机天然染料靛蓝,虽存在一定毒性,但被德意志第二帝国作为军服染料长时间使用,后北洋政府、国民政府也以其为正规军队的标准染料。再后在中国,因军阀纷争和日本入侵,中国军队的军服染料鱼龙混杂,从土黄到深蓝五花八门,而各路武装中,以国民政府“中央军”为优先供给单位,包括供应使用普鲁士蓝染料的军服统一着装,后又成为电视剧中的一个特色。.
晶体场理论
晶体场理论(Crystal field theory,首字母縮略字:CFT)是配位化学理论的一种,1929-1935年由汉斯·贝特和約翰·凡扶累克提出。它以过渡金属配合物的电子层结构为出发点,可以很好地解释配合物的磁性、颜色、立体构型、热力学性质和配合物畸变等主要问题,但不能合理解释配体的光谱化学序列和一些金属有机配合物的形成。 晶体场理论将配位键看成纯离子键,着眼于中心原子的d轨道在各种对称性配位体静电场中的变化,简明直观,结合实验数据容易进行定量或半定量的计算。但在实际配合物中,纯离子键或纯共价键都很罕见,目前配合物的结构理论兼有晶体场理论和分子轨道理论的精髓,称之为配位场理论。.
18电子规则
18电子规则又称有效原子序数法则(EAN),是过渡金属簇合物化学中比较重要的一个经验规则,常用来预测金属配合物的结构和稳定性。过渡金属价电子层有5个(n)d、1个(n+1)s和3个(n+1)p轨道,共可容纳2*9.
新!!: 配合物和18电子规则 · 查看更多 »
2,3-二巯基丁二酸
#重定向 二巯基丁二酸.
新!!: 配合物和2,3-二巯基丁二酸 · 查看更多 »
重定向到这里:
络合物,络离子,络盐,複合物,錯合物,錯離子,配位化合物,配位化学,配合物的异构现象,配离子。


 比浏览器更快的访问!
比浏览器更快的访问!

